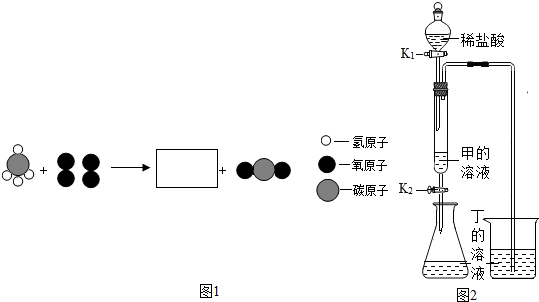
4. 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成.
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关.
【进行实验】
【解释与结论】
(1)NaOH与CO2反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
(2)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与NaOH浓度有关,浓度过高会使酚酞褪色.
(4)实验3的操作步骤:取3支试管,分别加入2mL水,分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液.
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为0.5%.
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是未排除酒精对酚酞溶解的影响.
 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成.
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关.
【进行实验】
| 实验 | 实验操作 | 实验现象 | |
| 1 | 向盛有2mL Na2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 | |
| 2 |  | 1号试管0.1min红色褪去 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 | |
| 3 | 取3支试管,分别加入2mL水,… | 酚酞溶液浓度/% | 浑浊程度 |
| 5 | 大量浑浊物 | ||
| 2 | 少量浑浊物 | ||
| 0.5 | 无浑浊物 | ||
(1)NaOH与CO2反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
(2)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与NaOH浓度有关,浓度过高会使酚酞褪色.
(4)实验3的操作步骤:取3支试管,分别加入2mL水,分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液.
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为0.5%.
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是未排除酒精对酚酞溶解的影响.
16.纳米材料具有特殊的性质和功能.纳米二氧化钛(TiO2)参与的光催化反应可使吸附在其表面的甲醛等物质被氧化,降低空气中有害物质的浓度.正钛酸(H4TiO4)在一定条件下分解失水可制得纳米TiO2.下列说法不正确的是( )
0 164370 164378 164384 164388 164394 164396 164400 164406 164408 164414 164420 164424 164426 164430 164436 164438 164444 164448 164450 164454 164456 164460 164462 164464 164465 164466 164468 164469 164470 164472 164474 164478 164480 164484 164486 164490 164496 164498 164504 164508 164510 164514 164520 164526 164528 164534 164538 164540 164546 164550 164556 164564 211419
| A. | 甲醛对人体健康有害 | |
| B. | 纳米TiO2添加到墙面涂料中,可消除甲醛 | |
| C. | 纳米TiO2与普通的TiO2的性质、功能完全相同 | |
| D. | 制备纳米TiO2的反应:H4TiO4$\frac{\underline{\;一定条件\;}}{\;}$TiO2+2H2O |