题目内容
20.生物浸出技术在金属冶炼中应用广泛.嗜热细菌在65-80℃酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分CuFeS2)产生硫酸盐,进而生产铜和绿矾,主要流程如下: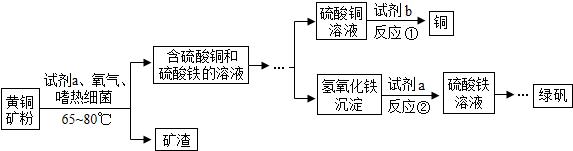
(1)分离出矿渣的操作是过滤.
(2)若试剂b为Fe粉,反应①的化学方程式为Fe+CuSO4═FeSO4+Cu.
(3)氢氧化铁与试剂a发生中和反应,反应②的化学方程式为2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O.
分析 (1)根据过滤是把不溶于液体的固体与液体分离的一种方法,进行分析解答.
(2)若试剂b为Fe粉,铁的金属活动性比铜强,能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,写出反应的化学方程式即可.
(3)氢氧化铁难溶于水,转化为硫酸铁溶液,应是氢氧化铁与硫酸反应,据此进行分析解答.
解答 解:(1)过滤是把不溶于液体的固体与液体分离的一种方法,分离出矿渣,同时分离出含硫酸铜和硫酸铁的溶液,则该操作是过滤.
(2)若试剂b为Fe粉,铁的金属活动性比铜强,能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
(3)氢氧化铁难溶于水,转化为硫酸铁溶液,应是氢氧化铁与硫酸反应,生成硫酸铁和水,反应的化学方程式为:2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O.
故答案为:(1)过滤;(2)Fe+CuSO4═FeSO4+Cu;(3)2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O.
点评 本题难度不大,掌握过滤的原理、金属与酸的化学性质、化学方程式的书写方法是正确解答本题的关键.

练习册系列答案
相关题目
4. 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )| A. | 水 | B. | 纯碱溶液 | C. | 澄清石灰水 | D. | 稀盐酸 |
11.现向12gMgO和CuO的某混合物中加入稀硫酸至恰好完全溶解,再向所得溶液中加入NaOH溶液至恰好沉淀完全,生成Mg(OH)2和Cu(OH)2沉淀的总质量为15.6g,则参加反应的NaOH的质量为( )
| A. | 3.6g | B. | 4.0g | C. | 8.0g | D. | 16.0g |
15.钙是构成人体骨骼和牙齿的重要组分.这里的“钙”是指( )
| A. | 钙元素 | B. | 钙原子 | C. | 钙单质 | D. | 钙离子 |
10. 操作和保存药品不当,标签常常易损毁.现有四瓶溶液①②③④的试剂标签已破损(如图),但是已经知道这四瓶试剂是NaOH、Ca(OH)2、Na2CO3、KCl溶液中的一种,某兴趣小组同学决定对四瓶破损标签溶液成分进行实验探究(实验另外药品只提供盐酸和酚酞溶液):
操作和保存药品不当,标签常常易损毁.现有四瓶溶液①②③④的试剂标签已破损(如图),但是已经知道这四瓶试剂是NaOH、Ca(OH)2、Na2CO3、KCl溶液中的一种,某兴趣小组同学决定对四瓶破损标签溶液成分进行实验探究(实验另外药品只提供盐酸和酚酞溶液):
【提出问题】标签已经破损的①②③④四瓶溶液分别是什么溶液?
【实验探究1】第④瓶试剂肯定是:KCl(写化学式).
【实验探究2】兴趣小组对①②③④瓶溶液进行了如下的实验探究:
【反思与交流】为了防止标签发生破损,我们在倾倒溶液时应注意:倾倒药品时,标签应向手心.
 操作和保存药品不当,标签常常易损毁.现有四瓶溶液①②③④的试剂标签已破损(如图),但是已经知道这四瓶试剂是NaOH、Ca(OH)2、Na2CO3、KCl溶液中的一种,某兴趣小组同学决定对四瓶破损标签溶液成分进行实验探究(实验另外药品只提供盐酸和酚酞溶液):
操作和保存药品不当,标签常常易损毁.现有四瓶溶液①②③④的试剂标签已破损(如图),但是已经知道这四瓶试剂是NaOH、Ca(OH)2、Na2CO3、KCl溶液中的一种,某兴趣小组同学决定对四瓶破损标签溶液成分进行实验探究(实验另外药品只提供盐酸和酚酞溶液):【提出问题】标签已经破损的①②③④四瓶溶液分别是什么溶液?
【实验探究1】第④瓶试剂肯定是:KCl(写化学式).
【实验探究2】兴趣小组对①②③④瓶溶液进行了如下的实验探究:
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| 1 | 取①②③瓶溶液少量 于三支试管中,分别 加入酚酞试液 | 三瓶溶液都使无色酚酞变红色 | 酚酞试液不能将其中 的一种溶液鉴别出来 |
| 2 | 再取①②③瓶溶液少 量于另外三支试管中 分别加入稀盐酸溶液 | 加入了①溶液的试管 中产生大量气泡; 其余两支试管中无明显现象 | ①瓶溶液为Na2CO3 |
| 3 | 取②③瓶溶液少量于 两支试管中,分别加 入碳酸钠溶液 | 加入了②溶液的试管 中无明显现象; 加入了③溶液的试管 中产生白色沉淀; | ②瓶溶液为氢氧化钠 ③瓶溶液为 Ca(OH)2 |



 某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用,如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答相关问题:
某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用,如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答相关问题: