11.下列物质都属于纯净物的一组是( )
①冰水混合物 ②洁净的空气 ③液氮 ④石灰水.
①冰水混合物 ②洁净的空气 ③液氮 ④石灰水.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
10.下列有关金属材料的说法正确的是( )
| A. | 硬铝片比纯铝片硬度小 | B. | 钢的性能优良,是很纯的铁 | ||
| C. | 沙漠地区的铁制品锈蚀较快 | D. | 为防止钢铁生锈,可在其表面涂油 |
9.空气是一种宝贵的自然资源.下列措施中,不利于提高空气质量的是( )
| A. | 开发新能源代替化石燃料 | B. | 改进汽车尾气的净化技术 | ||
| C. | 节假日燃放烟花爆竹 | D. | 控制PM2.5的排法以减少雾霾天气 |
7.空气中氧气含量测定的再认识.

【实验回顾】如图是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.
(1)写出红磷燃烧的化学方程式4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内气压减小,烧杯中水倒吸到集气瓶.若装置的气密性良好,操作规范,用量筒测量进人瓶中水的体积,能粗略测得空气中氧气的含量.
【问题提出】有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大.
【实验改进】
Ⅰ.根据铁在空气中生锈的原理设计图2实验装置,再次测定空气中氧气含量.装置中饱和食盐水、活性炭会加速铁生锈.
Ⅱ.测得实验数据如表
【交流表达】
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式2Fe+2H2O+O2=2Fe(OH)2.
(2)根据如表数据计算,改进实验后测得的空气中氧气的体积分数是20.2%(计算结果精确到0.1%).
(3)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:
①铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;
②测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.

【实验回顾】如图是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.
(1)写出红磷燃烧的化学方程式4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内气压减小,烧杯中水倒吸到集气瓶.若装置的气密性良好,操作规范,用量筒测量进人瓶中水的体积,能粗略测得空气中氧气的含量.
【问题提出】有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大.
【实验改进】
Ⅰ.根据铁在空气中生锈的原理设计图2实验装置,再次测定空气中氧气含量.装置中饱和食盐水、活性炭会加速铁生锈.
Ⅱ.测得实验数据如表
| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积/mL | 80.0 | 54.5 | 126.0 |
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式2Fe+2H2O+O2=2Fe(OH)2.
(2)根据如表数据计算,改进实验后测得的空气中氧气的体积分数是20.2%(计算结果精确到0.1%).
(3)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:
①铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;
②测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.
6.分析处理图表中的信息是学习化学的一种重要方法.
(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
①40℃时,氯化钠的溶解度为36.6g.
②碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%(计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
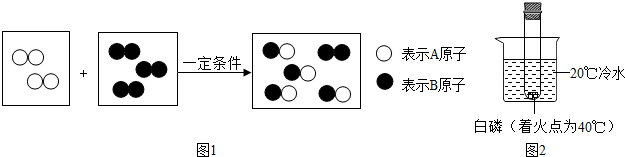
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl=FeCl2+H2↑.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC(填标号).
(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%(计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl=FeCl2+H2↑.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC(填标号).

5.“比较归纳法”是学习化学的一种重要方法.(“-”表示相连的两种物质能发生反应,“→”表示某种物质可通过一步反应转化为另一种物质.)
(1)请以表2中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格:
(2)室温下,氯化镁与下列物质的变化关系,正确的是AD(填标号).
A.MgCl2-AgN03
B.KN03→MgCl2
C.MgCl2-HCl
D.Mg(OH)2→MgCl2.
(1)请以表2中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格:
| 项目 序号 | 举例 | 物质类别间的相互反应 | 物质类别间的相互转化 |
| Ⅰ | CaCl2+Na2CO3=CaCO3↓+2NaCl | 盐1-盐2 | 盐→新盐 |
| Ⅱ | 写出硫酸与氯化钡反应的化学方程式BaCl2+H2SO4═BaSO4↓+2HCl | 酸-盐 | 酸→新酸 |
| Ⅲ | 写出氢氧化钠转变成另一种碱的2NaOH+CuSO4=Na2SO4+Cu(OH)2↓; | 碱-盐 | 碱→新碱 |
A.MgCl2-AgN03
B.KN03→MgCl2
C.MgCl2-HCl
D.Mg(OH)2→MgCl2.
3.下列鉴别物质所用的方法或试剂,错误的是( )
| A. | 氧气和氮气-观察颜色 | B. | 铁粉和炭粉-用稀硫酸 | ||
| C. | 羊毛和化学纤维-点燃闻气味 | D. | 氢氧化钠溶液和水-用酚酞溶液 |
2.下列应用与中和反应原理无关的是( )
0 164111 164119 164125 164129 164135 164137 164141 164147 164149 164155 164161 164165 164167 164171 164177 164179 164185 164189 164191 164195 164197 164201 164203 164205 164206 164207 164209 164210 164211 164213 164215 164219 164221 164225 164227 164231 164237 164239 164245 164249 164251 164255 164261 164267 164269 164275 164279 164281 164287 164291 164297 164305 211419
| A. | 用浓硫酸干燥湿润的氧气 | |
| B. | 用熟石灰改良酸性土壤 | |
| C. | 服用含氢氧化铝的药物治疗胃酸过多 | |
| D. | 用氢氧化钠溶液洗涤石油产品中的残留硫酸 |