题目内容
6.分析处理图表中的信息是学习化学的一种重要方法.(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%(计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
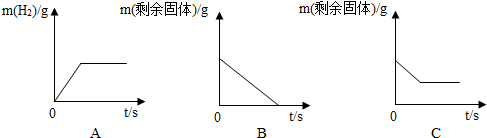
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl=FeCl2+H2↑.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC(填标号).
分析 (1)根据表格中两种物质在不同温度下的溶解度数据来分析解答;
(2)根据金属的活动性顺序以及反应过程来分析.
解答 解:(1)由表格可知,①40℃时,氯化钠的溶解度为36.6g;故填:36.6;
②碳酸钠的溶解度随温度的升高而增大;在20℃时,碳酸钠的溶解度为21.8g,也就是在该温度下的100g水中最多溶解碳酸钠21.8g,此时加入30g不能完全溶解,形成了该温度下的饱和溶液,30℃时碳酸钠的溶解度为39.7g,完全溶解了,此时溶液中溶质的质量分数为:$\frac{30g}{30g+100g}×100%$≈23.1%;故填:增大;饱和溶液;23.1%;
③10℃时,分别配制表中两种物质的饱和溶液,该温度下,溶解度小的,饱和溶液中溶质的质量分数越小,故填:碳酸钠饱和溶液;
(2)根据金属的活动性顺序可知,铁与稀盐酸反应生成氯化亚铁和氢气,而铜与稀盐酸不反应;随着反应的进行,氢气的质量增加,当铁完全反应后,氢气的质量不再改变;随着铁的反应,金属混合物的质量不断减小,当铁完全反应后,剩余固体是铜.故填:Fe+2HCl=FeCl2+H2↑;AC.
点评 本题考查了物质的溶解度与温度的关系以及有关溶液的计算,还考查了金属的活动性,难度不大.

练习册系列答案
相关题目
16.下列说法中正确的是( )
| A. | 凡是均一稳定的液体一定是溶液 | |
| B. | 溶液一定是无色的,且溶剂一定是水 | |
| C. | 硝酸铵溶于水时温度降低 | |
| D. | 只有固体、气体可以作为溶质 |
17.已知CaH2与Ca的混合物1g,两者均能与水反应生成Ca(OH)2和H2.现将其加入到足量的Na2CO3溶液中,充分反应后过滤、洗涤、干燥称得CaCO32.4g,则样品中CaH2的质量分数为( )
| A. | 40% | B. | 50% | C. | 84% | D. | 96% |
14.二氧化钛(TiO2)可作水分解的光催化剂,其中氧元素为-2价,则钛元素的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
1.如图是某物质的分子模型,下列关于该物质说法正确的是( )


| A. | 属于有机物 | B. | 化学式为NH3 | ||
| C. | 氮元素和氢元素的质量比为3:1 | D. | 氢元素的质量分数=$\frac{1}{17}$×100%=5.9% |
11.下列物质都属于纯净物的一组是( )
①冰水混合物 ②洁净的空气 ③液氮 ④石灰水.
①冰水混合物 ②洁净的空气 ③液氮 ④石灰水.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
15.目前我国自主研发的抗癌新药西达本胺即将全球上市.西达本胺由分子构成,其化学式为C22H19FN4O2,下列关于西达本胺的说法不正确的是( )
| A. | 西达本胺是一种化合物 | |
| B. | 西达本胺由五种元素组成 | |
| C. | 一个西达本胺分子含有48个原子 | |
| D. | 西达本胺分子中氟、氮、氧三种原子的个数比为1:2:1 |
 表示Na+的结构示意图
表示Na+的结构示意图