5.如图是某个化学反应的微观示意图,从示意图中获取的信息不正确的是( )

| A. | 图①分子中两种原子的个数比为1:2 | B. | 图②对应的物质是单质 | ||
| C. | 反应前后原子的种类和个数不变 | D. | 两种生成物的分子个数比为1:2 |
4. 甲、乙两种固体物质的溶解度曲线如图所示.下列说法不正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列说法不正确的是( )
 甲、乙两种固体物质的溶解度曲线如图所示.下列说法不正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列说法不正确的是( )| A. | t2℃时,甲的溶解度大于乙的溶解度 | |
| B. | 降温可使甲的不饱和溶液变为饱和溶液 | |
| C. | t2℃时,40g乙加入100g水中得到乙的不饱和溶液 | |
| D. | t1℃时,甲、乙两种饱和溶液的溶质质量分数相等 |
3.下列说法不正确的是( )
| A. | 点燃氢气前一定要检验其纯度 | |
| B. | 可燃冰就是干冰,主要成分为CO2 | |
| C. | 乙醇是一种很好的燃料,属于可再生能源 | |
| D. | 化石燃料主要包括煤、石油、天然气,属于不可再生能源 |
20.现有下列4种物质,选择相应物质的字母填空.
A.石墨 B.小苏打 C.酒精 D.聚乙烯塑料
(1)C可用于作实验室燃料
(2)A可用于制轻轨电刷
(3)D可用于制造保鲜膜
(4)B可用于治疗胃酸过多.
A.石墨 B.小苏打 C.酒精 D.聚乙烯塑料
(1)C可用于作实验室燃料
(2)A可用于制轻轨电刷
(3)D可用于制造保鲜膜
(4)B可用于治疗胃酸过多.
19.如图所示的变化中,属于化学变化的是( )
0 163278 163286 163292 163296 163302 163304 163308 163314 163316 163322 163328 163332 163334 163338 163344 163346 163352 163356 163358 163362 163364 163368 163370 163372 163373 163374 163376 163377 163378 163380 163382 163386 163388 163392 163394 163398 163404 163406 163412 163416 163418 163422 163428 163434 163436 163442 163446 163448 163454 163458 163464 163472 211419
| A. |  分馏石油 | B. |  净化水 | ||
| C. |  蒸发食盐水 | D. |  燃烧红磷 |
 甲、乙两同学在学完酸的化学性质后,做了如下实验:
甲、乙两同学在学完酸的化学性质后,做了如下实验: (1)12号元素的原子形成的离子是Mg2+(写离子符号),16号元素的原子最外层电子数为6,地壳中含量最多的金属元素和非金属元素组成的化合物是Al2O3(写化学式).
(1)12号元素的原子形成的离子是Mg2+(写离子符号),16号元素的原子最外层电子数为6,地壳中含量最多的金属元素和非金属元素组成的化合物是Al2O3(写化学式).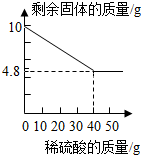 南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.
南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.