题目内容
18. 南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.
南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.(1)体育馆内照明的导线大多数是铜导线,用铜做导线是利用金属铜的延展性和导电性.
(2)体育馆雄伟壮观的主体建筑使用了大量的金属铝板,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是4Al+3O2=2Al2O3.
(3)砳砳(lèlè)是2014年南京青奥会吉祥物,其外材料为纯羊毛,内充PET纤维.PET纤维属于合成纤维(选填“天然纤维”、“合成纤维”).
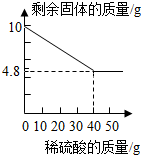
(4)小彭同学想对家中一只10g手镯(银锌合金)中银的含量进行探究.在老师的指导下:他将该手镯放在烧杯中,用足量的稀硫酸分多次加入并与手镯充分反应,实验结果如图所示.
①如果小彭同学用所得的纯银制作一枚戒指,其质量不会超过4.8g克.
②试计算所用稀硫酸的溶质质量分数.(请在答卷纸上写出计算过程)
分析 (1)根据金属的物理性质分析;
(2)根据反应物和产物书写化学方程式;
(3)根据已有的材料的组成和材料的区别进行分析;
(4)①由实验结果进行分析,所剩固体就是不能与稀硫酸反应的银;
②根据实验结果求出锌的质量,然后结合化学方程式求算出稀硫酸的质量分数.
解答 解:(1)用铜做导线是利用金属铜的延展性和导电性;
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化铝,化学方程式为:4Al+3O2=2Al2O3;
(3)PET纤维是有机合成材料,是合成纤维;
(4)①由实验结果可知,所剩固体就是不能与稀硫酸反应的银;故10g手镯中银的质量为4.8g,所以要用所得的银制作一枚戒指,其质量不会超过4.8g;
②设稀硫酸中溶质质量为x,固体中锌的质量为:10g-4.8g=5.2g
Zn+H2SO4═ZnSO4+H2↑
65 98
5.2g x
$\frac{65}{98}$=$\frac{5.2g}{x}$
x=7.84g
已知参加反应的稀硫酸的质量为40g,则所用稀硫酸的溶质质量分数是:$\frac{7.48g}{40g}$×100%=19.6%;
故答案为:(1)延展;(2)4Al+3O2=2Al2O3;(3)合成纤维;(4)①4.8;②19.6%;
点评 本题考查金属的物理性质,化学方程式的书写,合成纤维,化学方程式的有关计算等,知识点较多,基础性较强.

练习册系列答案
相关题目
8.下列说法中不符合质量守恒定律的是( )
| A. | 蜡烛燃烧后,质量变小了 | |
| B. | 镁条燃烧后,质量变大了 | |
| C. | 食盐和水混合搅拌后,质量不变 | |
| D. | 硫酸铜溶液和氢氧化钠溶液混合振荡后,质量不变 |
9.2010年俄、美科学家发现了两种新原子,它们的质子数都是117,中子数分别为117和118.下列有关叙述正确的是( )
| A. | 因为两种原子的质子数相同,所以两种原子的质量也相同 | |
| B. | 两种原子属于同种元素 | |
| C. | 中子数为118的原子,核外有118个电子 | |
| D. | 中子数为117的原子,相对原子质量为117 |
6.下列有关物质的分类,错误的是( )
| A. | 空气属于化合物 | |
| B. | 液氧属于单质 | |
| C. | 氮气属于纯净物 | |
| D. | 五氧化二磷既是氧化物,又是含氧化合物 |
3.下列说法不正确的是( )
| A. | 点燃氢气前一定要检验其纯度 | |
| B. | 可燃冰就是干冰,主要成分为CO2 | |
| C. | 乙醇是一种很好的燃料,属于可再生能源 | |
| D. | 化石燃料主要包括煤、石油、天然气,属于不可再生能源 |
7.安徽的特色小吃品种繁多,历史悠久,独具地方特色.以下是省内几个地市的著名特色小吃,风味独特.其中所含营养物质维生素较多的是( )
| A. | 六安酱鸭 | B. | 黄山烧饼 | C. | 合肥荠菜圆子 | D. | 太和板面 |
 小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红,是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红呢?小宁设计了如图三个实验,请小宁、小明和你一起探究并完成下列问题:
小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红,是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红呢?小宁设计了如图三个实验,请小宁、小明和你一起探究并完成下列问题: