3. 小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.
小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.
请根据实验回答问题:
(1)将实验组二所缺内容填充完整0.03g过氧化氢酶.
(2)检查图甲装置气密性的操作方法是将导管一端放入水中,然后用双手紧握吸滤瓶的外壁,若导管口有气泡冒出,则说明该装置的气密性良好.
(3)如果装置气密性良好,反应完全实验结束后,请你预测三组压强测量仪器的最终读数大小关系相等.
 小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.
小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.| 实验组别 | 质量分数为3%的过氧化氢溶液 | 催化剂 | 压强计度数 |
| 组一 | 10mL | 清水2mL | 极缓慢增大 |
| 组二 | 10mL | 0.03g过氧化氢酶 | 快速增大 |
| 组三 | 10mL | 0.03克MnO2 | 慢慢增大 |
(1)将实验组二所缺内容填充完整0.03g过氧化氢酶.
(2)检查图甲装置气密性的操作方法是将导管一端放入水中,然后用双手紧握吸滤瓶的外壁,若导管口有气泡冒出,则说明该装置的气密性良好.
(3)如果装置气密性良好,反应完全实验结束后,请你预测三组压强测量仪器的最终读数大小关系相等.
2.小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题.她设计并完成了下表所示的探究实验:
(1)请你帮小丽同学填写上表中未填完的空格.
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是对比.
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明.
第一方面的实验操作中包含了两次称量,其目的是:证明反应前后二氧化锰的质量不变;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验.接下来的实验操作、现象和结论是:操作:向“实验三”反应后试管内加入5mL5%的过氧化氢溶液,伸入带火星的木条;
现象:有气泡产生,木条复燃;
结论:反应前后二氧化锰的化学性质不变.
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 结论 | 总结 | |||
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是速率慢,氧气少. | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | 氧化锰与水不能反应放出氧气 | |
| 实验三 | 取5mL5%的过氧化氢溶液于试管中,向试管中加入二氧化锰,伸入带火星的木条 | 有气泡产生,木条复燃 | 二氧化锰能加快过氧化氢的分解 | |
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是对比.
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明.
第一方面的实验操作中包含了两次称量,其目的是:证明反应前后二氧化锰的质量不变;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验.接下来的实验操作、现象和结论是:操作:向“实验三”反应后试管内加入5mL5%的过氧化氢溶液,伸入带火星的木条;
现象:有气泡产生,木条复燃;
结论:反应前后二氧化锰的化学性质不变.
1.学校化学兴趣小组的同学知道二氧化锰能作过氧化氢分解的催化剂以后,想再探究其他一些物质如三氧化二铝是否也可作过氧化氢分解的催化剂.请你一起参与他们的探究过程,并填写下列空白:
(1)〔问题〕Al2O3能不能作过氧化氢分解的催化剂呢?
(2)〔猜想〕Al2O3能作过氧化氢分解的催化剂.
(3)〔实验验证〕
(4)〔结论〕Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
(5)〔讨论与反思〕经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验(实验三):
〔实验目的〕探究化学反应前后Al2O3质量是否发生改变.
〔实验步骤〕①准确称量少量Al2O3 的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤、洗涤、烘干、称量;④反应前后进行对比.
〔讨论〕如果Al2O3在反应前后质量不变,也不能说明Al2O3可以作过氧化氢分解的催化剂.
理由是还应设计实验:探究Al2O3的化学性质是否发生变化.
(1)〔问题〕Al2O3能不能作过氧化氢分解的催化剂呢?
(2)〔猜想〕Al2O3能作过氧化氢分解的催化剂.
(3)〔实验验证〕
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 装有过氧化氢溶液的试管中伸入带火星的木条 | 木条不复燃 | 常温下过氧化氢溶液的分解速率很慢 |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
(5)〔讨论与反思〕经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验(实验三):
〔实验目的〕探究化学反应前后Al2O3质量是否发生改变.
〔实验步骤〕①准确称量少量Al2O3 的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤、洗涤、烘干、称量;④反应前后进行对比.
〔讨论〕如果Al2O3在反应前后质量不变,也不能说明Al2O3可以作过氧化氢分解的催化剂.
理由是还应设计实验:探究Al2O3的化学性质是否发生变化.
14.图表资料可以为我们提供很多信息.下面是某学生对图标资料的使用,其中正确的是( )
| A. | 根据某元素的原子结构示意图判断该元素原子核中有几个中子 | |
| B. | 根据密度数据判断液体物质挥发性的大小 | |
| C. | 根据“各种物质在不同温度时的溶解度表”,设计通过蒸发、结晶把混合溶液中某些物质分离出来的方法 | |
| D. | 根据物质熔点的不同,设计通过蒸馏的方法来进行物质的初步分离 |
13.(1)化学源于生活,与我们生活息息相关.请从以下物质中选择填空:
A.石墨 B.硫酸铁 C.甲烷
D.食醋 E.硝酸钾 F.二氧化硫
请从A~F中选择符合下表类别的物质,用其化学式填空(每空只填一个化学式):
(2)工业炼铁反应原理是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.将生锈的铁放入盛有足量稀硫酸的烧杯中,写出此反应的化学方程式Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,Fe+H2SO4=FeSO4+H2↑.
(3)炼铝原料水铝石的主要成分是Al(OH)3,它被医疗上被用为治疗胃病(成分是盐酸)的化学原理是Al(OH)3+3HCl=AlCl3+3H2O(用化学方程式表示).
A.石墨 B.硫酸铁 C.甲烷
D.食醋 E.硝酸钾 F.二氧化硫
请从A~F中选择符合下表类别的物质,用其化学式填空(每空只填一个化学式):
| 类 别 | 单 质 | 氧化物 | 盐 |
| 化学式 | C | SO2 | Fe2(SO4)3(或KNO3) |
(3)炼铝原料水铝石的主要成分是Al(OH)3,它被医疗上被用为治疗胃病(成分是盐酸)的化学原理是Al(OH)3+3HCl=AlCl3+3H2O(用化学方程式表示).
12.如图是某密闭容器中物质变化的微观示意图,其中(“●”代表氧原子,“○”代表硫原子)下列说法不正确的是( )

0 159479 159487 159493 159497 159503 159505 159509 159515 159517 159523 159529 159533 159535 159539 159545 159547 159553 159557 159559 159563 159565 159569 159571 159573 159574 159575 159577 159578 159579 159581 159583 159587 159589 159593 159595 159599 159605 159607 159613 159617 159619 159623 159629 159635 159637 159643 159647 159649 159655 159659 159665 159673 211419

| A. | 变化I中的“一定条件”可能是升高温度 | |
| B. | 变化Ⅱ发生的是分解反应 | |
| C. | 变化Ⅱ中反应涉及的三种分子 : : : : 的个数比为2:2:1 的个数比为2:2:1 | |
| D. | 在示意图中所有物质均为氧化物 |
 模型可以反映客观现象,简单明了地表示事物.如图所示是某同学构建的硫酸铵[(NH4)2SO4]各元素质量分数的模型.则硫酸铵由四种元素组成,图中A表示的是氧元素.
模型可以反映客观现象,简单明了地表示事物.如图所示是某同学构建的硫酸铵[(NH4)2SO4]各元素质量分数的模型.则硫酸铵由四种元素组成,图中A表示的是氧元素.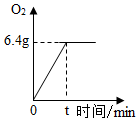 CuSO4是一种重要的化工原料,电解CuSO4溶液可制得O2等物质,发生的化学反应如下:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4,现取一定质量的溶质质量分数为10%的CuSO4溶液进行电解,当CuSO4完全反应时,停止通电,生成O2的质量与时间的关系如图所示,请计算:
CuSO4是一种重要的化工原料,电解CuSO4溶液可制得O2等物质,发生的化学反应如下:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4,现取一定质量的溶质质量分数为10%的CuSO4溶液进行电解,当CuSO4完全反应时,停止通电,生成O2的质量与时间的关系如图所示,请计算: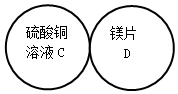 用四个圆表示A(铁片)、B(稀硫酸)、C(硫酸铜溶液)、D(镁片)四种物质,用两圆相切表示两种物质可以发生反应,如图所示.请回答下列问题:(提示:物质间均恰好完全反应,其中稀硫酸与硫酸铜溶液不反应)
用四个圆表示A(铁片)、B(稀硫酸)、C(硫酸铜溶液)、D(镁片)四种物质,用两圆相切表示两种物质可以发生反应,如图所示.请回答下列问题:(提示:物质间均恰好完全反应,其中稀硫酸与硫酸铜溶液不反应)