题目内容
15.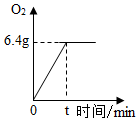 CuSO4是一种重要的化工原料,电解CuSO4溶液可制得O2等物质,发生的化学反应如下:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4,现取一定质量的溶质质量分数为10%的CuSO4溶液进行电解,当CuSO4完全反应时,停止通电,生成O2的质量与时间的关系如图所示,请计算:
CuSO4是一种重要的化工原料,电解CuSO4溶液可制得O2等物质,发生的化学反应如下:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4,现取一定质量的溶质质量分数为10%的CuSO4溶液进行电解,当CuSO4完全反应时,停止通电,生成O2的质量与时间的关系如图所示,请计算:(1)参加反应的CuSO4是多少克?
(2)反应后所得溶液中溶质的质量分数是多少?(计算结果精确到0.1%)
分析 由题意,反应的化学方程式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4,由生成O2的质量与时间的关系图,最终产生氧气的质量为6.4g,据此由反应的化学方程式计算出参加反应的硫酸铜、生成硫酸的溶质量,进而计算出所得溶液中溶质的质量分数即可.
解答 解:设参加反应的CuSO4质量为x,生成的硫酸的溶质量为y,生成铜的质量为z,
2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2Cu+2H2SO4
320 32 128 196
x 6.4g z y
$\frac{320}{x}=\frac{32}{6.4g}=\frac{128}{z}=\frac{196}{y}$
x=64g,y=39.2g,z=25.6g
反应后所得溶液中溶质的质量分数是$\frac{39.2g}{64g÷10%-6.4g-25.6g}×$100%≈6.4%.
答:(1)参加反应的CuSO4是64g;(2)反应后所得溶液中溶质的质量分数是6.4%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析图表信息,找出氧气的质量是正确解答本题的前提和关键.

练习册系列答案
相关题目
5.2017年安徽民生热词“舌尖上的安全”.下列做法符合食品安全要求的是( )
| A. | 用亚硝酸钠代替食盐烹调食物 | B. | 用碳酸氢钠作发酵粉 | ||
| C. | 用霉变油菜籽生成食用油 | D. | 用工业酒精勾兑饮用白酒 |
3.如图是氯化铵和氯化钠两种固体物质的溶解度曲线,下列叙述错误的是( ) 

| A. | t1℃时,NaCl和NH4C1两种物质各自的溶液中,所含溶质的质量分数相等 | |
| B. | t2℃时,NH4Cl的溶解度大于NaCl的溶解度 | |
| C. | t2℃时,向18g NaCl固体中加入50g水,充分搅拌后固体能全部溶解,形成氯化钠的饱和溶液 | |
| D. | NH4Cl中含有少量NaCl,可以用冷却热饱和溶液的方法提纯NH4Cl |
3. 小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.
小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.
请根据实验回答问题:
(1)将实验组二所缺内容填充完整0.03g过氧化氢酶.
(2)检查图甲装置气密性的操作方法是将导管一端放入水中,然后用双手紧握吸滤瓶的外壁,若导管口有气泡冒出,则说明该装置的气密性良好.
(3)如果装置气密性良好,反应完全实验结束后,请你预测三组压强测量仪器的最终读数大小关系相等.
 小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.
小明经过科学学习了解到酶是高效的生物催化剂,小明利用过氧化氢酶或二氧化锰作催化剂制取氧气时,设计的实验装置如图所示,并设计了如下表所示的三组实验进行探究.| 实验组别 | 质量分数为3%的过氧化氢溶液 | 催化剂 | 压强计度数 |
| 组一 | 10mL | 清水2mL | 极缓慢增大 |
| 组二 | 10mL | 0.03g过氧化氢酶 | 快速增大 |
| 组三 | 10mL | 0.03克MnO2 | 慢慢增大 |
(1)将实验组二所缺内容填充完整0.03g过氧化氢酶.
(2)检查图甲装置气密性的操作方法是将导管一端放入水中,然后用双手紧握吸滤瓶的外壁,若导管口有气泡冒出,则说明该装置的气密性良好.
(3)如果装置气密性良好,反应完全实验结束后,请你预测三组压强测量仪器的最终读数大小关系相等.
7.在一定条件下跟酸、碱、盐都能反应的物质是( )
| A. | 氧化铁 | B. | 碳酸钙 | C. | 碳酸钠 | D. | 硝酸钾 |
8. “煤的气化”是指将煤转化为气体燃料-水煤气,有关反应的微观本质如图所示:下列有关该反应的说法错误的是( )
“煤的气化”是指将煤转化为气体燃料-水煤气,有关反应的微观本质如图所示:下列有关该反应的说法错误的是( )
 “煤的气化”是指将煤转化为气体燃料-水煤气,有关反应的微观本质如图所示:下列有关该反应的说法错误的是( )
“煤的气化”是指将煤转化为气体燃料-水煤气,有关反应的微观本质如图所示:下列有关该反应的说法错误的是( )| A. | 煤是不可再生能源 | B. | 该反应属于置换反应 | ||
| C. | 图中只有一种氧化物 | D. | 反应中乙、丙的质量比是9:14 |






