4.下列有关燃烧与灭火的说法正确的是( )
| A. | “吹灭蜡烛”灭火的原理,是使可燃物与氧气隔绝 | |
| B. | 只要温度达到着火点,可燃物就一定燃烧 | |
| C. | 图书、档案失火,通常用水基型灭火器扑灭 | |
| D. | 身上的衣物着火,可就地打滚使火熄灭 |
3.下列物质与对应的用途不相符合的是( )
| A. | 小苏打--可治疗胃酸过多 | B. | 氯化钠--可用作融雪剂 | ||
| C. | 氧气--可作燃料 | D. | 二氧化碳--可作气体肥料 |
2.氯化钠俗名食盐是工业生产和生活的一种重要原料,也是实验室里常见的一种药品.下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题;
(1)表中 m=13.6;
(2)在这4次实验中,得到的是20℃氯化钠溶液属于饱和溶液的是③④(填实验序号)
(3)计算第3次实验得到的氯化钠溶液的溶质质量分数.(写出过程)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液释成5%的氯化钠溶液,需加水多少毫升?(写出过程)
| 实验序号 | 水的质量(g) | 加入氯化钠的质量(g) | 溶液的质量(g) |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | m |
(2)在这4次实验中,得到的是20℃氯化钠溶液属于饱和溶液的是③④(填实验序号)
(3)计算第3次实验得到的氯化钠溶液的溶质质量分数.(写出过程)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液释成5%的氯化钠溶液,需加水多少毫升?(写出过程)
20. 蜡烛(主要含C、H、O元素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?小敏认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:
蜡烛(主要含C、H、O元素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?小敏认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:
①燃烧的产物可能有CO2.
②燃烧的产物可能有H2O.
除了上述猜想,你的猜想,燃烧的产物可能有C或CO或含有C、CO2、H2O和CO四种物质的任意组合.
实验一:在密闭容器中点燃蜡烛至熄灭,抽取10毫升密闭容器中的气体,注入到试管中的饱和澄清石灰水中,发现石灰水始终没有变浑浊,从实验的科学性考虑,下一步是B(选填字母).
A.直接得到燃烧产物中没有CO2的结论
B.再多抽取一些气体注入到试管中的石灰水中
C.增加饱和澄清石灰水的质量
实验二:在老师的指导下,利用多功能传感器进行有关量的测量,装置如图所示,实验结束后,铝板表面有黑色
固体颗粒,同时传感器采得实验前后的有关数据如表所示:
由实验及结果分析,密闭容器内蜡烛熄灭的原因是氧气含量下降,二氧化碳含量上升;蜡烛燃烧生成的产物是C、CO2、H2O和CO.
 蜡烛(主要含C、H、O元素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?小敏认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:
蜡烛(主要含C、H、O元素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?小敏认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:①燃烧的产物可能有CO2.
②燃烧的产物可能有H2O.
除了上述猜想,你的猜想,燃烧的产物可能有C或CO或含有C、CO2、H2O和CO四种物质的任意组合.
实验一:在密闭容器中点燃蜡烛至熄灭,抽取10毫升密闭容器中的气体,注入到试管中的饱和澄清石灰水中,发现石灰水始终没有变浑浊,从实验的科学性考虑,下一步是B(选填字母).
A.直接得到燃烧产物中没有CO2的结论
B.再多抽取一些气体注入到试管中的石灰水中
C.增加饱和澄清石灰水的质量
实验二:在老师的指导下,利用多功能传感器进行有关量的测量,装置如图所示,实验结束后,铝板表面有黑色
固体颗粒,同时传感器采得实验前后的有关数据如表所示:
| 相对湿度 | 氧气含量 | 二氧化碳含量 | 一氧化碳含量 | |
| 蜡烛点燃前 | 48.4% | 18.7% | 0.058% | 0 |
| 蜡烛熄灭后 | 71.6% | 15.6% | 3.643% | 0.0182% |
15.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们仪器完成以下实验探究.
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想Ⅲ是正确的.
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
0 158047 158055 158061 158065 158071 158073 158077 158083 158085 158091 158097 158101 158103 158107 158113 158115 158121 158125 158127 158131 158133 158137 158139 158141 158142 158143 158145 158146 158147 158149 158151 158155 158157 158161 158163 158167 158173 158175 158181 158185 158187 158191 158197 158203 158205 158211 158215 158217 158223 158227 158233 158241 211419
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
| 实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
| 实验操作 | 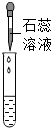 | 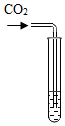 | 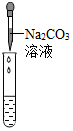 |
| 实验现象 | 溶液变为蓝色 | 溶液变浑浊 | 产生白色沉淀 |
| 实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.







