11.不停地加热一杯不饱和硝酸钾溶液,蒸发溶剂,以下关于溶液发生的变化正确的是( )
| A. | 整个过程中,硝酸钾溶液的质量分数不断增大 | |
| B. | 整个过程中,硝酸钾的溶解度不断增大 | |
| C. | 整个过程中,始终不断有硝酸钾晶体析出 | |
| D. | 析出晶体后,温度不变,加热相同时间析出的晶体质量相同 |
10.以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图.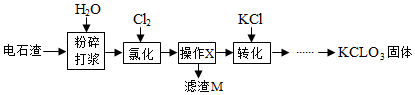
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】

查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入几滴无色酚酞试液; | 观察到溶液变红色现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到固体溶解并有气泡产生现象 | 猜想③正确 |
8.下列图象能正确反映对应的实验操作的是( )
| A. |  向一定量的饱和石灰水中加入氧化钙 | |
| B. |  加热一定量碳酸钙固体产生二氧化碳气体 | |
| C. |  用一定量的双氧水制取氧气 | |
| D. |  向一定量的硫酸铜溶液中放入铁钉 |
6.过氧化钠常用作呼吸面具里的供养剂.兴趣小组取适量过氧化钠粉末,加入到一定量水中,充分反应后,滴入几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,小组同学对此现象产生好奇.
【提出问题】什么原因导致溶液先变红再褪色
【查阅资料】过氧化钠(Na2O2)是一种浅黄白色颗粒粉末,在空气中吸收水分和二氧化碳,易溶于水,能与水发生反应生成氢氧化钠和过氧化氢.
【猜想与假设】猜想1:甲同学:“可能是无色酚酞溶液变质导致溶液褪色;”
猜想2:乙同学:“可能是生成的过氧化氢使溶液褪色.”
【实验与结论】(1)猜想1,其他同学一致认为不合理,理由是如果是无色酚酞溶液变质,刚开始就不会先变成红色了;
(2)乙同学设计了以下方案进行实验,证明自己的猜想:
【拓展】有同学从资料上得知氢氧化钠溶液浓度过大能导致溶液颜色褪去,他们又进行了以下的实验探究.
【提出问题】什么原因导致溶液先变红再褪色
【查阅资料】过氧化钠(Na2O2)是一种浅黄白色颗粒粉末,在空气中吸收水分和二氧化碳,易溶于水,能与水发生反应生成氢氧化钠和过氧化氢.
【猜想与假设】猜想1:甲同学:“可能是无色酚酞溶液变质导致溶液褪色;”
猜想2:乙同学:“可能是生成的过氧化氢使溶液褪色.”
【实验与结论】(1)猜想1,其他同学一致认为不合理,理由是如果是无色酚酞溶液变质,刚开始就不会先变成红色了;
(2)乙同学设计了以下方案进行实验,证明自己的猜想:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后,往试管中滴加过氧化氢溶液,观察现象. | 溶液仍然为红色 | 不是过氧化氢使溶液褪色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量原溶液于试管中,加入适量的水. | 溶液变成红色 | 氢氧化钠溶液浓度过大,导致溶液颜色褪去 |
5. 在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
探究一 M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是Ca(OH)2,②是CaCl2.
【收集资料】CaCl2水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
探究二 过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH和Na2CO3;猜想二:NaOH和Ca(OH)2;猜想三:NaOH
(3)【实验验证】同学们针对“猜想一”进行了如下实验:
他们的实验结论是否正确?不正确,理由是溶液中氢氧化钠能与加入的少量盐酸反应,即使溶液中有Na2CO3溶液也可能不产生气体.
 在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.探究一 M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是Ca(OH)2,②是CaCl2.
【收集资料】CaCl2水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于 试管中,向其中滴加酚酞溶液. | 酚酞溶液变红色. | 猜想①正确,碳酸钠与其反应的化学 方程为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
【提出猜想】猜想一:NaOH和Na2CO3;猜想二:NaOH和Ca(OH)2;猜想三:NaOH
(3)【实验验证】同学们针对“猜想一”进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气体产生. | “猜想一”不成立 |
3.某同学家中有一袋化肥,可能混入了其他化肥,且化肥包装袋上字迹模糊.该同学进行了如下探究,请你参与探究并填空:
【提出问题】该化肥中含有什么物质?
【收集信息】经询问得知,该化肥可能为铵态氮肥.
【提出猜想】该化肥所含的阴离子可能是Cl-、CO32-、SO42-中的一种或几种.
【实验、记录与分析】
【实验结论】若该化肥中只含有一种阳离子,则其中一定含有的物质是(写化学式):
(NH4)2SO4和NH4Cl.
【实验反思】在步骤(2)中,产生的白色沉淀是硫酸钡;若用氯化钡溶液代替硝酸钡溶液否(选填“是”或“否”)可行,请简要说明原因:氯化钡代替硝酸钡则影响氯离子的检验.
【提出问题】该化肥中含有什么物质?
【收集信息】经询问得知,该化肥可能为铵态氮肥.
【提出猜想】该化肥所含的阴离子可能是Cl-、CO32-、SO42-中的一种或几种.
【实验、记录与分析】
| 实验操作步骤 | 实验现象 | 实验分析 |
| (1)取少量该化肥样品和少量氢氧化钙放在研钵中混合研磨 | 产生有刺激性气味的气体 | 含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,过滤. | 产生白色沉淀, 且沉淀不溶解. | 没有碳酸根离子存在 |
| (3)取(2)所得滤液少量于试管中,滴加硝酸银溶液 | 产生白色沉淀 | 有Cl- |
(NH4)2SO4和NH4Cl.
【实验反思】在步骤(2)中,产生的白色沉淀是硫酸钡;若用氯化钡溶液代替硝酸钡溶液否(选填“是”或“否”)可行,请简要说明原因:氯化钡代替硝酸钡则影响氯离子的检验.
2. 实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.为确定该液体成分,同学们进行了如下实验探究:
实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.为确定该液体成分,同学们进行了如下实验探究:
【反思交流】(1)大家认为标签受损的原因可能是在倾倒液体时标签未朝向手心.
(2)如果该液体是过氧化氢溶液,则步骤一中产生的变化用化学方程式表示为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
0 157546 157554 157560 157564 157570 157572 157576 157582 157584 157590 157596 157600 157602 157606 157612 157614 157620 157624 157626 157630 157632 157636 157638 157640 157641 157642 157644 157645 157646 157648 157650 157654 157656 157660 157662 157666 157672 157674 157680 157684 157686 157690 157696 157702 157704 157710 157714 157716 157722 157726 157732 157740 211419
 实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.为确定该液体成分,同学们进行了如下实验探究:
实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.为确定该液体成分,同学们进行了如下实验探究:| 实验操作 | 实验现象 | 实验结论 |
| 步骤一:取该液体适量于试管中,向其中加入少量二氧化锰粉末 | 没有气泡产生 | 该液体不是过氧化氢溶液 |
| 步骤二:取该液体适量于试管中,向其中滴加少量氯化钡溶液 | 产生白色沉淀 | 该液体是稀硫酸 |
(2)如果该液体是过氧化氢溶液,则步骤一中产生的变化用化学方程式表示为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.



 某初级中学学生为探究该校化学实验室的一种黑色粉末和一瓶标签破损的无色溶液(如右图所示)可能是什么物质,大胆猜想并设计实验进行验证.
某初级中学学生为探究该校化学实验室的一种黑色粉末和一瓶标签破损的无色溶液(如右图所示)可能是什么物质,大胆猜想并设计实验进行验证.