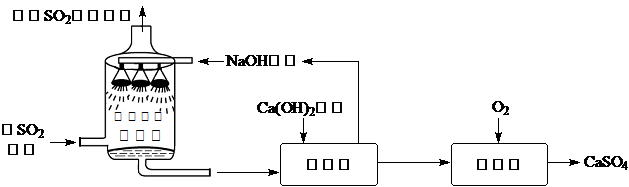17.下列仪器的名称不正确的是( )
| A. |  酒精灯 | B. |  量筒 | C. |  试管 | D. |  长颈漏斗 |
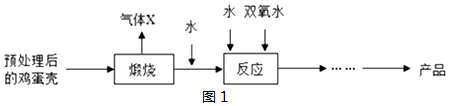
15.某中学化学兴趣小组同学在老师的指导下进行气体的制备和性质的探究.

(1)写出图1中标号为a的仪器的名称集气瓶.
(2)图1仪器可用于实验室制取CO2,选择其中的AFG或BG(填字母)仪器可组装一套制取CO2的发生装置,该反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)实验室常用过氧化氢溶液制氧气,该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,实验室若需要干燥的氧气,则收集氧气前应先将氧气通过H装置,H装置中的液体d是浓硫酸,气体通过H时,应从b(填“b”或“c”)端进入.
(4)化学很多实验都与压强有关.
小张同学设计了“喷泉实验”(如图2所示),挤压胶头滴管使其中少量的水进入烧瓶,打开止水夹,烧瓶中就可以看到红色的喷泉,形成喷泉的原理是氨气溶于水,使内外产生压强差.小张同学进一步实验,用CO2代替氨气(NH3)做“喷泉实验”,结果现象不明显,未看到预期的“喷泉”,小张把胶头滴管中的水换成了氢氧化钠溶液,得到了较好的效果.

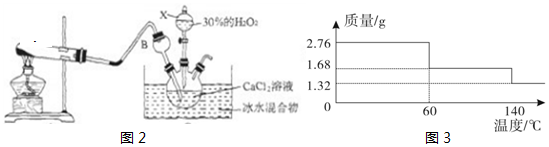
如图3所示,将X滴加到Y中,通过U形管中液面的变化(忽略加入一定体积X导致的液面变化),下列实验得出的结论正确的是ABCD

(1)写出图1中标号为a的仪器的名称集气瓶.
(2)图1仪器可用于实验室制取CO2,选择其中的AFG或BG(填字母)仪器可组装一套制取CO2的发生装置,该反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)实验室常用过氧化氢溶液制氧气,该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,实验室若需要干燥的氧气,则收集氧气前应先将氧气通过H装置,H装置中的液体d是浓硫酸,气体通过H时,应从b(填“b”或“c”)端进入.
(4)化学很多实验都与压强有关.
小张同学设计了“喷泉实验”(如图2所示),挤压胶头滴管使其中少量的水进入烧瓶,打开止水夹,烧瓶中就可以看到红色的喷泉,形成喷泉的原理是氨气溶于水,使内外产生压强差.小张同学进一步实验,用CO2代替氨气(NH3)做“喷泉实验”,结果现象不明显,未看到预期的“喷泉”,小张把胶头滴管中的水换成了氢氧化钠溶液,得到了较好的效果.

如图3所示,将X滴加到Y中,通过U形管中液面的变化(忽略加入一定体积X导致的液面变化),下列实验得出的结论正确的是ABCD
| 选项 | A | B | C | D |
| X | 稀盐酸 | 水 | 稀盐酸 | 水 |
| Y | 金属镁 | 生石灰 | NaOH固体 | 硝酸铵固体 |
| 液面 变化 | a处液面下降 b处液面上升 | a处液面下降 b处液面上升 | a处液面下降 b处液面上升 | b处液面下降 a处液面上升 |
| 结论 | 该反应放热 | 该反应放热 | 说明中和 反应放热 | 硝酸铵溶 于水吸热 |
14.在一密闭容器内有四种物质,在一定条件下发生充分反应,测得反应前后各物质的质量如表:
已知该反应的方程式中甲与丁的化学计量数的比为1:2,则下列说法不正确的是( )
| 甲 | 乙 | 丙 | 丁 | |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应至t时刻的质量/g | 2 | a | b | 17 |
| 反应后的质量/g | 0 | 22 | 9 | d |
| A. | d的数值为9 | B. | b的数值为4 | ||
| C. | 甲和丁为反应物 | D. | 丁的相对分子质量为甲的2倍 |
13.利用废硫酸制备K2SO4的流程如图.则下列说法不正确的是( )


| A. | 流程中CaCO3可循环使用 | |
| B. | 将CaCO3研成粉末的目的使反应更充分 | |
| C. | M和碱混合微热产生无色无味气体 | |
| D. | 洗涤所得晶体,是为了除去表面的杂质 |
12.如图是A、B两种固体物质的溶解度曲线,下列说法一定正确的是( )


| A. | 物质A的溶解度大于B的溶解度 | |
| B. | 36℃时,A的饱和溶液溶质质量分数为60% | |
| C. | 若A中含少量的B杂质,可通过降温结晶提纯A | |
| D. | 18℃时,A、B的饱和溶液中所含溶质的质量相等 |
10.目前使用的燃料大多来自化石燃料.
(1)写出天然气中甲烷完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)分析下表,与煤相比,用天然气作燃料的优点有等质量的天然气和煤完全燃烧,天然气燃烧产生二氧化碳的质量少于煤,放出的热量多于煤.
(3)为提高煤的利用率,可将其转化为可燃性气体,该反应的微观示意图如下,则生成物的分子个数比为1:1.

(1)写出天然气中甲烷完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)分析下表,与煤相比,用天然气作燃料的优点有等质量的天然气和煤完全燃烧,天然气燃烧产生二氧化碳的质量少于煤,放出的热量多于煤.
| 1g物质完全燃烧 | ||
| 产生二氧化碳的质量/g | 放出的热量/kJ | |
| 甲烷 | 2.75 | 56 |
| 煤碳 | 3.67 | 32 |

9.推理是化学学习中常用的思维方法,下列推理正确的是( )
0 156852 156860 156866 156870 156876 156878 156882 156888 156890 156896 156902 156906 156908 156912 156918 156920 156926 156930 156932 156936 156938 156942 156944 156946 156947 156948 156950 156951 156952 156954 156956 156960 156962 156966 156968 156972 156978 156980 156986 156990 156992 156996 157002 157008 157010 157016 157020 157022 157028 157032 157038 157046 211419
| A. | CO2和SO2都能和NaOH溶液反应,CO也能和NaOH溶液反应 | |
| B. | CO和C都能和CuO反应生成Cu,有还原性,H2也能相CuO反应生成Cu,也有还原性 | |
| C. | 活泼金属和盐酸反应生成气体,和盐酸反应生成气体的物质不一定是活发金属 | |
| D. | 氢氧化钙和氢氧化钠都属于碱,都含有金属元素,所以碱都含有金属元素 |