19.空气中的固体颗粒物如PM2.5、PM10、PM10+等过多易形成雾霾,它容易诱发呼吸道疾病.根据国务院发布的新的《环境空气质量标准》,下列项目不必列入监测范围的是( )
| A. | 一氧化氮 | B. | 二氧化硫 | C. | 二氧化碳 | D. | PM2.5 |
17.化学是以实验为基础的自然科学,通过实验可以得知物质的组成、结构、性质及其变化规律.下列通过实验得出的结论正确的是( )
| A. | 把燃着的木条插入某无色气体中,火焰熄灭,该气体一定是二氧化碳 | |
| B. | 白磷可以在氧气中燃烧,说明氧气具有可燃性 | |
| C. | 某物质经鉴定只含有一种元素,则该物质一定是单质 | |
| D. | 某反应属于置换反应,则一定生成单质和化合物 |
16.实验室常用的制备气体的部分装置如图所示,请根据要求完成问题.

①写出图中编号仪器的名称:a铁架台,b长颈漏斗
②实验室用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,应选用的发生和收集装置是AD(填装置编号),其中二氧化锰的作用是催化作用.
③用装置C做气体发生装置的适用范围是块状固体和液体不需加热的反应.
④某班级学生通过实验确定制取二氧化碳的原料.
⑤两组同学将④中甲、乙、丙三支试管的剩余溶液倒入各自的废液缸中,观察到了不同的现象,记录并分析如下.

①写出图中编号仪器的名称:a铁架台,b长颈漏斗
②实验室用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,应选用的发生和收集装置是AD(填装置编号),其中二氧化锰的作用是催化作用.
③用装置C做气体发生装置的适用范围是块状固体和液体不需加热的反应.
④某班级学生通过实验确定制取二氧化碳的原料.
| 试管编号 | 实验步骤 | 现象 | 结论 | |
| 甲 | 稀盐酸中放入粉末状碳酸钠 | 反应剧烈 | 产生 大量 气泡 | 选择稀盐酸和块状碳酸钙为原料最合适,该反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑. |
| 乙 | 稀盐酸中放入粉末状碳酸钙 | |||
| 丙 | 稀盐酸中放入块状碳酸钙 | 反应平稳 | ||
| 倒入废液缸前的现象 | 倒入废液缸后的现象 | 相关分析 | |
| 第一组 | 各试管中均无固体 | 有气泡产生 | 试管甲中剩余溶液的pH>7 (填“>”、“=”或“<”). |
| 第二组 | 各试管中均无固体 | 无明显现象 | 废液缸中溶液的溶质是一定有NaCl、CaCl2,可能有HCl. |
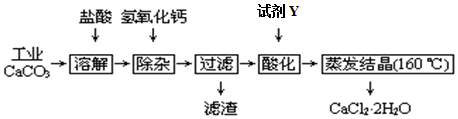
13.医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
已知:查阅资料得知氢氧化物沉淀时的pH为:
(1)CaCO3与盐酸反应的离子方程式CaCO3+2H+=Ca 2++H2O+CO2↑
(2)除杂操作是加入氢氧化钙,调节溶液的pH范围应为2.3≤pH≤7.8(提示:找出PH范围的两个边界值,并选择适当的数学符号“<、>、≤、≥”,组成形如“边界值1<PH<边界值2”等等的不等式来表示PH范围),其目的是让铁离子和氯离子完全沉淀.
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和漏斗
(4)酸化的目的是:除去过量的氢氧化钙.所加试剂Y 名称为盐酸
(5)蒸发结晶要保持在160℃,为什么温度不能太高:由于要制备的是水合物,温度太高会导致水合物分解脱水.
(6)若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一是过程中除去了铁离子和氯离子,而钠离子没有去除,导致得到的水合物含有钠的化合物.
0 156736 156744 156750 156754 156760 156762 156766 156772 156774 156780 156786 156790 156792 156796 156802 156804 156810 156814 156816 156820 156822 156826 156828 156830 156831 156832 156834 156835 156836 156838 156840 156844 156846 156850 156852 156856 156862 156864 156870 156874 156876 156880 156886 156892 156894 156900 156904 156906 156912 156916 156922 156930 211419

已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(2)除杂操作是加入氢氧化钙,调节溶液的pH范围应为2.3≤pH≤7.8(提示:找出PH范围的两个边界值,并选择适当的数学符号“<、>、≤、≥”,组成形如“边界值1<PH<边界值2”等等的不等式来表示PH范围),其目的是让铁离子和氯离子完全沉淀.
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和漏斗
(4)酸化的目的是:除去过量的氢氧化钙.所加试剂Y 名称为盐酸
(5)蒸发结晶要保持在160℃,为什么温度不能太高:由于要制备的是水合物,温度太高会导致水合物分解脱水.
(6)若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一是过程中除去了铁离子和氯离子,而钠离子没有去除,导致得到的水合物含有钠的化合物.
 甲、乙两种物质(均不含结晶水)的溶解度曲线如图所示,请回答.
甲、乙两种物质(均不含结晶水)的溶解度曲线如图所示,请回答. 在一次用餐中,某同学对燃料“固体酒精”产生了好奇,于是对其成分进行了探究.
在一次用餐中,某同学对燃料“固体酒精”产生了好奇,于是对其成分进行了探究.

 如图中A、B对比说明燃烧需要的条件是燃烧需要氧气(或空气),若B、C同样证明此条件,并且时间短现象明显,可以向烧杯C中最好加入固体、液体为①(填序号)
如图中A、B对比说明燃烧需要的条件是燃烧需要氧气(或空气),若B、C同样证明此条件,并且时间短现象明显,可以向烧杯C中最好加入固体、液体为①(填序号)