1. 我国劳动人民早在五千年前就会使用木炭炼铜.化学兴趣小组采用如图装置,开展以下探究活动
我国劳动人民早在五千年前就会使用木炭炼铜.化学兴趣小组采用如图装置,开展以下探究活动
【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】(1)木炭与CuO的反应是:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4═Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③Cu和Cu2O.
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再取少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入试管的内.
(2)按图连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清石灰水变浑浊,此时停止加热.
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
【评价反思】
若要证明CaC12是该反应的催化剂,还需要验证CaCl2的质量和化学性质在反应前后不变.
 我国劳动人民早在五千年前就会使用木炭炼铜.化学兴趣小组采用如图装置,开展以下探究活动
我国劳动人民早在五千年前就会使用木炭炼铜.化学兴趣小组采用如图装置,开展以下探究活动【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】(1)木炭与CuO的反应是:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4═Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③Cu和Cu2O.
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再取少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入试管的内.
(2)按图连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清石灰水变浑浊,此时停止加热.
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
| 步骤 | 现象 | 结论 |
| ①取1.44g红色固体装入试管,滴入足量的稀硫酸,充分反应 | 红色固体部分减少,溶液变为蓝色 | 猜想①错误 |
| ②过滤出试管中残留的红色固体,洗涤干燥,称其质量为1.04g | 猜想③正确 |
若要证明CaC12是该反应的催化剂,还需要验证CaCl2的质量和化学性质在反应前后不变.
20.某老师在某工厂废水处理池中提取一瓶含有AgNO3、Cu(NO3)2和Al(NO3)3的工业废水样品带回实验室.
静置,取上层清液,加入锌粉,充分反应后过滤,得到滤液甲和滤渣乙.请完成以下探究(不考虑杂质干扰).
【提出问题】滤渣乙是什么?
【做出猜想】小明认为滤渣乙是银,小东认为滤渣乙是银和铜,小华认为滤渣乙是银、铜和铝,你认为滤渣乙还可能是银、铜和锌.
【交流讨论】大家经过讨论后,认为小华的猜想错误,理由是锌不和硝酸铝溶液反应.
【实验探究】设计实验探究滤渣乙的成分,请填写下列空白:
写出废水样品和锌粉反应的任意一个化学方程式Zn+2AgNO3=Zn(NO3)2+2Ag.
【反思交流】通过交流,大家认为在滤液甲中加入稀盐酸,当观察到无变化,也能得出实验1的结论.
写出此反应涉及的化学方程式HCl+AgNO3=HNO3+AgCl↓.
静置,取上层清液,加入锌粉,充分反应后过滤,得到滤液甲和滤渣乙.请完成以下探究(不考虑杂质干扰).
【提出问题】滤渣乙是什么?
【做出猜想】小明认为滤渣乙是银,小东认为滤渣乙是银和铜,小华认为滤渣乙是银、铜和铝,你认为滤渣乙还可能是银、铜和锌.
【交流讨论】大家经过讨论后,认为小华的猜想错误,理由是锌不和硝酸铝溶液反应.
【实验探究】设计实验探究滤渣乙的成分,请填写下列空白:
| 实验步骤 | 现象 | 结论 |
| 实验1:取滤渣乙加入盐酸 | 无气体产生 | 滤渣乙可能是银或铜和银 |
| 实验2:取滤液甲加入氢氧化钠 | 无蓝色沉淀 | 滤渣乙一定是铜和银 |
【反思交流】通过交流,大家认为在滤液甲中加入稀盐酸,当观察到无变化,也能得出实验1的结论.
写出此反应涉及的化学方程式HCl+AgNO3=HNO3+AgCl↓.
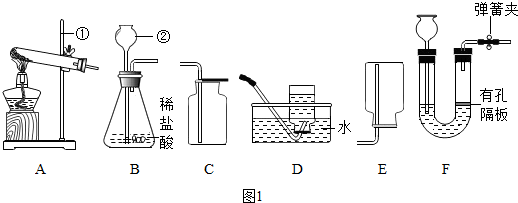
19.根据下列实验装置图,回答问题.
(1)写出图中仪器a的名称长颈漏斗.
(2)实验室用过氧化氢和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,气体发生装置为B(填字母).
(3)实验室用石灰石和稀盐酸制取CO2的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应生成的CO2中常混有少量氯化氢气体,可用盛有饱和NaHCO3溶液的F装置将其除去,混合气体应从F装置的②口(填“①”或“②”)通入.
| 发生装置 | 收集装置 | 洗气装置 |
 |  |  |
(2)实验室用过氧化氢和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,气体发生装置为B(填字母).
(3)实验室用石灰石和稀盐酸制取CO2的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应生成的CO2中常混有少量氯化氢气体,可用盛有饱和NaHCO3溶液的F装置将其除去,混合气体应从F装置的②口(填“①”或“②”)通入.
16.学习化学要用归纳思维.从下列探究实验中,得出相应的结论,并归纳其可能的一般规律.
| 序号 | 实验过程 | 实验现象 | 本实验得出的结论 | 可能的一般规律 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 | 反应物的本性决定化学反应速度 | |
| 2 | 铁粉和铁片分别与10%盐酸反应 | 铁粉产生气体快 | ||
| 3 | 铁片分别与5%盐酸和10%盐酸反应 | 10%盐酸产生气体快 | 盐酸浓度越大反应速度越快 |
14.小强取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的方法,取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下列(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)请计算:
(1)8g的石灰石样品中含有杂质1克
(2)上表中m的数值=3
(3)8g石灰石样品完全反应生成二氧化碳多少克?
0 150945 150953 150959 150963 150969 150971 150975 150981 150983 150989 150995 150999 151001 151005 151011 151013 151019 151023 151025 151029 151031 151035 151037 151039 151040 151041 151043 151044 151045 151047 151049 151053 151055 151059 151061 151065 151071 151073 151079 151083 151085 151089 151095 151101 151103 151109 151113 151115 151121 151125 151131 151139 211419
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 1 | 10 | 5.5 |
| 2 | 10 | m |
| 3 | 10 | 1.0 |
| 4 | 10 | 1.0 |
(2)上表中m的数值=3
(3)8g石灰石样品完全反应生成二氧化碳多少克?