10.小华同学设计中和反应实验操作:向氢氧化钠溶液中直接滴加稀盐酸.为确定氢氧化钠是否和盐酸恰好完全反应,他取出少量反应后的溶液倒入一只试管中,向其中滴加酚酞试液,振荡观察到酚酞试液不变色,于是得出:“两种物质恰好完全反应”
(1)小亮认为小华的结论不准确,他认为还有第二种可能性,这种可能性是:稀盐酸过量.
(2)请你设计另外一个实验探究该反应后的溶液是否恰好完全反应
(1)小亮认为小华的结论不准确,他认为还有第二种可能性,这种可能性是:稀盐酸过量.
(2)请你设计另外一个实验探究该反应后的溶液是否恰好完全反应
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中,加入锌粒 | 没有气泡产生. | 两种物质恰好完全反应 |
7.硫原子的相对原子质量是( )
| A. | 32 g | B. | 32 | C. | 5.314×10-26 kg | D. | 32 kg |
6.某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如图1:

(一)产品制备
(1)流程图中X的化学式为CO2;
(2)反应②分两步进行,化学方程式分别为:
第一步2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,第二步CuO+H2SO4═CuSO4+H2O;
(3)硫酸铜的溶解度如表:
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为20%;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时硫酸铜溶解度小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓.
(二)组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2和CuCO3都能受热分解,分别生成两种氧化物,其中Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃.为测定其组成,小组同学称取石青样品34.6g,用如图2装置进行实验.
(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得 a:b=2:1.
(7)若缺少F装置,测得的a:b的值会偏大(选填“偏大”、“偏小”、“不变”).
(三)脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图2实验装置C中进行加热,测定固体质量随温度的变化情况如图3所示.
(8)G点固体的化学式是CuSO4•H2O.
(9)H点所得固体的颜色是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑+5H2O↑.
0 149753 149761 149767 149771 149777 149779 149783 149789 149791 149797 149803 149807 149809 149813 149819 149821 149827 149831 149833 149837 149839 149843 149845 149847 149848 149849 149851 149852 149853 149855 149857 149861 149863 149867 149869 149873 149879 149881 149887 149891 149893 149897 149903 149909 149911 149917 149921 149923 149929 149933 149939 149947 211419

(一)产品制备
(1)流程图中X的化学式为CO2;
(2)反应②分两步进行,化学方程式分别为:
第一步2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,第二步CuO+H2SO4═CuSO4+H2O;
(3)硫酸铜的溶解度如表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓.
(二)组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2和CuCO3都能受热分解,分别生成两种氧化物,其中Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃.为测定其组成,小组同学称取石青样品34.6g,用如图2装置进行实验.
(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得 a:b=2:1.
(7)若缺少F装置,测得的a:b的值会偏大(选填“偏大”、“偏小”、“不变”).
(三)脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图2实验装置C中进行加热,测定固体质量随温度的变化情况如图3所示.
(8)G点固体的化学式是CuSO4•H2O.
(9)H点所得固体的颜色是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑+5H2O↑.
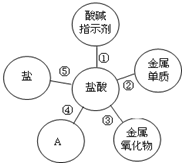 归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应).
归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应).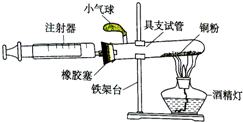 某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.
某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.

 ,写离子符号S2-,该元素的原子核外有3个电子层,它属于非金属元素(填“金属”或“非金属”),在化学反应中易得到(填“得到”或“失去”)电子.
,写离子符号S2-,该元素的原子核外有3个电子层,它属于非金属元素(填“金属”或“非金属”),在化学反应中易得到(填“得到”或“失去”)电子.