12.在30℃时,50 g水中最多溶解A物质5 g,在60℃时20 g水中最多能溶解B物质10 g,则( )
| A. | A的溶解度比B大 | B. | B的溶解度比A大 | ||
| C. | 二者的溶解度相等 | D. | 无法比较二者的溶解度大小 |
11.下列与人体的生理有关的叙述中,正确的是( )
| A. | 人体无法消化吸收纤维素,所以食物中的纤维素对人体毫无意义 | |
| B. | 煤气中毒主要是一氣化碳与血红蛋白结合,使血红蛋白失去输氧能力 | |
| C. | 作为健康饮食的一部分,建议长期饮用纯净水 | |
| D. | 容易患骨质疏松症,主要是缺乏铁元素 |
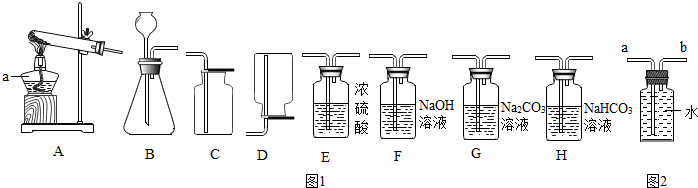
10.实验室常用图1装置制取气体,请你根据所学知识回答下列问题.
(1)仪器a的名称是酒精灯,a应在固定试管之前(选填“前”或“后”)放置.
(2)实验室制取氧气时,常用A装置制取并在试管口塞一团棉花,其化学反应方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;若选用B装置制取,其化学反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.选用的收集装置是C(填字母序号)若改用如图2装置收集气体,则气体应从b进(填“a”或“b”)
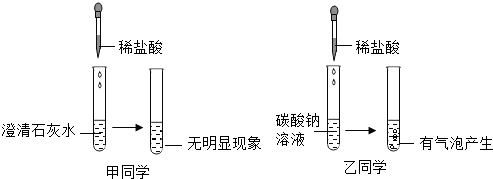
(3)甲同学在实验室制取二氧化碳的研究中,进行了如下实验:
Ⅰ.上述实验中反映的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号).
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积);.
Ⅳ.研究发现酸的浓度越大,产生的气体的速度越快,与甲比较,对丁分析正确的是AB
A.反应更为剧烈 B.最终剩余溶液的质量更小
C.产生的二氧化碳的质量更大 D.粉末状大理石利用率更高
(4)乙同学也取了一定浓度的盐酸与石灰石反应制取气体,并将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】
A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2.
②乙同学想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
【查阅资料】
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O=2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为BHEC(填字母).
0 147566 147574 147580 147584 147590 147592 147596 147602 147604 147610 147616 147620 147622 147626 147632 147634 147640 147644 147646 147650 147652 147656 147658 147660 147661 147662 147664 147665 147666 147668 147670 147674 147676 147680 147682 147686 147692 147694 147700 147704 147706 147710 147716 147722 147724 147730 147734 147736 147742 147746 147752 147760 211419
(1)仪器a的名称是酒精灯,a应在固定试管之前(选填“前”或“后”)放置.
(2)实验室制取氧气时,常用A装置制取并在试管口塞一团棉花,其化学反应方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;若选用B装置制取,其化学反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.选用的收集装置是C(填字母序号)若改用如图2装置收集气体,则气体应从b进(填“a”或“b”)
(3)甲同学在实验室制取二氧化碳的研究中,进行了如下实验:
| 药品实验编号 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号).
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积);.
Ⅳ.研究发现酸的浓度越大,产生的气体的速度越快,与甲比较,对丁分析正确的是AB
A.反应更为剧烈 B.最终剩余溶液的质量更小
C.产生的二氧化碳的质量更大 D.粉末状大理石利用率更高
(4)乙同学也取了一定浓度的盐酸与石灰石反应制取气体,并将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】
A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2.
②乙同学想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3溶液中 | 产生白色沉淀 | 气体中有HCl |
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O=2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为BHEC(填字母).


 人类利用化学变化,合成各种新材料,如合成纤维、合成塑料、合成橡胶等,新材料的应用,极大地促进了人.类社会的发展和人们生活水平的提高,请从化学视角回答下列问题:
人类利用化学变化,合成各种新材料,如合成纤维、合成塑料、合成橡胶等,新材料的应用,极大地促进了人.类社会的发展和人们生活水平的提高,请从化学视角回答下列问题:
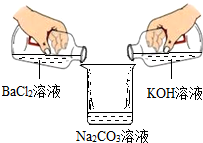 学习完盐的化学性质以后,同学们做了一个趣味实验.如图所示,它们在倾倒过程中观察到烧杯左侧的无色溶液中产生了白色沉淀.倾倒并经过沉降后,他们对最终烧杯内上层清液中所含有的离子展开了探究.
学习完盐的化学性质以后,同学们做了一个趣味实验.如图所示,它们在倾倒过程中观察到烧杯左侧的无色溶液中产生了白色沉淀.倾倒并经过沉降后,他们对最终烧杯内上层清液中所含有的离子展开了探究.