题目内容
14.烧杯A中装有t2℃时R物质的饱和溶液,进行如图操作,回答下列问题:
(1)如图1所示四种溶液中,一定不饱和的是B(填字母).
(2)R物质对应图2中溶解度曲线是丙(填“甲”或“乙”或“丙”,下同).
(3)将t2℃时等质量的甲乙丙三种物质的饱和溶液分别降至t1℃,三种溶液中溶质的质量分数由大到小的关系是乙>甲>丙
(4)从甲和乙的混合溶液中提纯固体乙,可以采用蒸发结晶的方法.
分析 (1)根据不饱和溶液的判断方法来分析;
(2)根据物质的溶解度受温度的影响进行分析;
(3)饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
(4)由于甲的溶解度随温度的升高而增大,而且受温度的影响较大,而乙的溶解度受温度的影响很小,因此提纯甲,可采取降温结晶的方法,故答案为:降温结晶(或冷却热饱和溶液).
解答 解:(1)因为B在t2℃还能继续溶解R物质,故为该温度下的不饱和溶液;故填:B;
(2)由题干信息可知,R的饱和溶解降温后还能继续溶解R物质,说明其溶解度随温度的降低而升高,故填:丙;
(3)分别将t2℃时,甲、乙、丙的饱和溶液降温至t1℃时,甲和乙仍然是饱和溶液,由于乙的溶解度在t1℃时大于甲的溶解度,因此乙的溶质质量分数大于甲;
因为甲在t1℃时溶解度大于丙在t2℃时溶解度,所以t1℃时加的质量分数大于丙的质量分数,则所得的三种溶液中溶质的质量分数由大到小的顺序是乙>甲>丙;
(4)由于甲的溶解度随温度的升高而增大,而且受温度的影响较大,而乙的溶解度受温度的影响很小,因此提纯乙,可采取蒸发结晶的方法.
故答案为:(1)B; (2)丙; (3)乙>甲>丙;(4)蒸发结晶;
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
4.如图是某反应的微观示意图,下列说法中正确的是( )


| A. | 该反应是复分解反应 | B. | 该反应中各元素化合价保持不变 | ||
| C. | 图中的化合物都属于氧化物 | D. | 该反应所得生成物质量之比为2:1 |
5.下列资源的利用过程中发生了化学变化的是( )
| A. | 海水晒盐 | B. | 干冰制冷 | C. | 风力发电 | D. | 铁矿炼铁 |
2.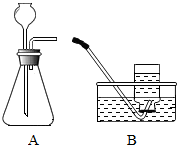 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;…
丙同学认为乙的猜想不科学,理由是.
【实验验证】用A、B两组仪器进行实验:
步骤一:检查装置气密性.连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好.
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL.称取2份形状相同锌粒各1g,分别与以上溶液反应.反应装置如图A所示.用此装置实验时,长颈漏斗下端要插入液面以下,目的是.
步骤三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如下表),什么时间开始收集气体?.
锌与硫酸反应的化学方程式是Zn+H2SO4=ZnSO4+H2↑.
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与铜离子有关.实验②中加入质量分数为10%的硫酸锌溶液1mL的作用是加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰.
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是.
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快.【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;…
丙同学认为乙的猜想不科学,理由是.
【实验验证】用A、B两组仪器进行实验:
步骤一:检查装置气密性.连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好.
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL.称取2份形状相同锌粒各1g,分别与以上溶液反应.反应装置如图A所示.用此装置实验时,长颈漏斗下端要插入液面以下,目的是.
步骤三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如下表),什么时间开始收集气体?.
| 编号 | 20%的稀硫酸各20mL | 锌粒 | 收集1瓶氢气所需的时间 |
| ① | 加入质量分数为10%的硫酸铜溶液1mL | 1g | 2分10秒 |
| ② | 加入质量分数为10%的硫酸锌溶液1mL | 1g | 3分01秒 |
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与铜离子有关.实验②中加入质量分数为10%的硫酸锌溶液1mL的作用是加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰.
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是.
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
| 编号 | 实验步骤 | 实验现象比较 | 实验结论 |
| ① | 取1g锌粒于锥形瓶中, 加入20mL 20%的稀硫酸 | 产生氢气的速率较快与铜单质有关 | |
| ② |
9.我们掌握了有关酸碱盐的知识后,化学课上老师分别利用碳酸钠溶液,氢氧化钙溶液、稀盐酸、酚酞溶液中的两种混合给大家表演魔术,a、b、c、d是上述四种溶液中的一种,过程如表:
请你帮助同学们揭开魔术的秘密.
(1)a为酚酞溶液;
(2)请写出乙试管中发生反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)将丙试管中的物质过滤,其滤液中溶质的组成可能有三种情况,请写出其中的一种情况NaOH、Ca(OH)2,为了验证你的猜想,你设计的方案是不用填.
(4)若将乙试管中的残液倒入甲试管中,可观察到红色溶液变为无色,且看到有气泡冒出,则该无色溶液中可能含有的离子是钠离子、氯离子.
| 操作步骤 | 1.取三支试管,分别加入a、b、c三种溶液 2.用胶头滴管往三支试管中分别滴加d溶液 | ||
 |  |  | |
| 魔术名称 | 变红酒 | 变汽水 | 变牛奶 |
| 现象 | 溶液呈红色 | 产生大量气泡 | 出现白色沉淀 |
(1)a为酚酞溶液;
(2)请写出乙试管中发生反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)将丙试管中的物质过滤,其滤液中溶质的组成可能有三种情况,请写出其中的一种情况NaOH、Ca(OH)2,为了验证你的猜想,你设计的方案是不用填.
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液与试管中,加入碳酸钠溶液 | 有白色沉淀生成 | 猜想正确 |
19. 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是NaCl、NaOH、Na2CO3、NaHCO3中的一种.小强和小华同学很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是NaCl、NaOH、Na2CO3、NaHCO3中的一种.小强和小华同学很感兴趣,决定对其成分进行探究:
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是A.
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.Na2CO3和NaHCO3溶液都呈碱性.
Ⅱ.NaHCO3溶液呈碱性.
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和表中的溶解度的数据判断,这瓶试剂不可能是NaHCO3.(填化学式)
【设计实验并继续探究】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得PH>7,这瓶试剂不可能是NaCl.(填化学式)
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
【拓展与应用】:请你选择与小强不同的试剂,来鉴别NaOH溶液和Na2CO3溶液,你选择CaCl2或Ca(OH)2 溶液.
【综合计算】现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠的质量分数,设计了如下实验方案.取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某盐酸中,测得三组实验数据见表(气体的溶解忽略不计)
根据实验及有关数据进行分析与计算:
(1)100g碱性调味液与盐酸完全反应生成气体的质量为5.5g.
(2)碱性调味液中碳酸钠的质量分数为多少?(写出计算过程)
 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是NaCl、NaOH、Na2CO3、NaHCO3中的一种.小强和小华同学很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是NaCl、NaOH、Na2CO3、NaHCO3中的一种.小强和小华同学很感兴趣,决定对其成分进行探究:【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是A.
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.Na2CO3和NaHCO3溶液都呈碱性.
Ⅱ.NaHCO3溶液呈碱性.
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
【设计实验并继续探究】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得PH>7,这瓶试剂不可能是NaCl.(填化学式)
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 盐酸(硫酸) | 产生大量的气泡 | 该溶液是Na2CO3 相关的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
【综合计算】现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠的质量分数,设计了如下实验方案.取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某盐酸中,测得三组实验数据见表(气体的溶解忽略不计)
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 盐酸的质量/g | 20 | 40 | 60 |
| 生成气体的质量/s | 2.2 | 4.4 | 5.5 |
(1)100g碱性调味液与盐酸完全反应生成气体的质量为5.5g.
(2)碱性调味液中碳酸钠的质量分数为多少?(写出计算过程)
4.下列各组物质用稀硫酸不能完全区分开的是( )
| A. | Na2CO3溶液、NaCl溶液、BaCl2溶液 | B. | 镁粉、氧化铜粉、木炭粉 | ||
| C. | NaOH溶液、Ba(OH)2溶液、KOH溶液 | D. | 锌片、铁片、银片 |

 Al;
Al;