题目内容
8. 小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质量为47.8g(不含烧杯质量,假定钙片其它成分不与
小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质量为47.8g(不含烧杯质量,假定钙片其它成分不与盐酸反应.)请帮她求出:
(1)生成二氧化碳的质量.
(2)稀盐酸中溶质的质量分数.
(3)通过计算判断钙片中碳酸钙的含量标注是否属实.
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钙和HCl的质量,进而求算对应的质量分数.
解答 解:根据质量守恒定律,二氧化碳的质量为:40.0g+2.5g/片×4片-47.8g=2.2g;
设该石灰石样品中碳酸钙的质量为x,稀盐酸中溶质的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 2.2g
$\frac{100}{x}$=$\frac{73}{y}$=$\frac{44}{2.2g}$
x=5.0g
y=3.65g
稀盐酸中溶质的质量分数为$\frac{3.65g}{40.0g}$×100%≈9.1%
钙片中碳酸钙的含量为$\frac{5.0g}{4}$=1.25g>1.24g.合格.
答:(1)生成二氧化碳的质量为2.2g.
(2)稀盐酸中溶质的质量分数为9.1%.
(3)通过计算 钙片中碳酸钙的含量标注属实.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.用如图装置电解水,一段时间后的现象如图所示.对该实验的描述错误的是( )


| A. | a试管中收集到的是一种可燃性气体 | |
| B. | 该实验能证明水是由氢元素和氧元素组成 | |
| C. | b试管中收集到的是氧气 | |
| D. | a、b两试管内收集到的气体的质量比约为2:1 |
16.已知SO2与 CO2有许多化学性质是相似的,亚硫酸钙(CaSO3)是白色难溶于水但可溶于酸的固体.某同学向一酸雨样品中滴加 CaCl2,溶液本观察到有浑浊现象,继续滴入NaOH溶液后即有白色沉淀产生.在以上实验过程中,下列不可能发生的化学反应是( )
| A. | SO2+CaCl2+H2O═CaSO3↓十2HCl | B. | SO2+2NaOH═Na2SO3+H2O | ||
| C. | Na2SO3+CaCl2=CaSO3↓+2NaCl | D. | H2SO3+2NaOH=Na2SO3+2H2O |
17.下列各组溶液中,不用其它任何试剂就能鉴别出来的是( )
| A. | FeCl3 NaOH HCl KCl | |
| B. | BaCl2 Na2SO4 NaOH HCl | |
| C. | CuSO4 NaCl KNO3 BaCl2 | |
| D. | KCl AgNO3 HCl HNO3 |
18.下列反应属于化合反应的是( )
| A. | 铁+硫酸→硫酸亚铁+氢气 | B. | 氧化钙+水→氢氧化钙 | ||
| C. | 乙炔+氧气$\stackrel{点燃}{→}$二氧化碳+水 | D. | 碳酸钙$\stackrel{高温}{→}$氧化钙+二氧化碳 |
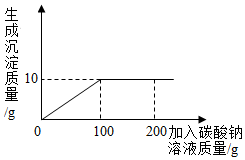 为测定由氯化钙和氯化钠组成的固体样品中氯化钙的含量,某同学进行了如下实验:取14克固体样品,全部溶于100克水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录并绘制了如图所示的曲线
为测定由氯化钙和氯化钠组成的固体样品中氯化钙的含量,某同学进行了如下实验:取14克固体样品,全部溶于100克水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录并绘制了如图所示的曲线 在用氢氧化钡溶液和溶质质量分数为7.3%的稀盐酸进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示.
在用氢氧化钡溶液和溶质质量分数为7.3%的稀盐酸进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示.  如表中1、2、3各项之间能构成如图包含关系的是( )
如表中1、2、3各项之间能构成如图包含关系的是( )