题目内容
10.工业上用“侯氏制碱法”生产的纯碱中往往含有少量的氯化钠.现将6g含有氯化钠的纯碱加入到一定量的溶质质量分数为7.3%稀盐酸中,恰好完全反应,收集到2.2g的气体(假设生成的气体全部逸出).计算反应后得到氯化钠溶液的溶质质量分数(计算结果保留到0.1%).分析 根据二氧化碳的质量以及碳酸钠与盐酸反应的方程式,求出反应后所得氯化钠溶液中溶质的质量即可.
解答 解:设碳酸钠的质量为x,氯化氢的质量为y,生成氯化钠的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x y z 2.2g
$\frac{106}{x}=\frac{73}{y}=\frac{117}{z}=\frac{44}{2.2g}$
x=5.3g
y=3.65g
z=5.85g
氯化钠溶液的质量为:6g+2.65g÷7.3%-2.2g=53.8g
氯化钠的质量为:5,85g+6g-5.3g=6.55g
氯化钠溶液的溶质质量分数为:$\frac{6.55g}{53.8g}×100%≈12.2%$
答:反应后得到氯化钠溶液溶质质量分数为12.2%.
点评 本题主要考查学生利用化学方程式和质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.C919的厨房为乘客提供了下列饮品:蒸馏水、雪碧、牛奶等.请从A或B两题中任选1个作答,若两题均作答,按A计分.
| A | B |
| (1)上述饮品中属于纯净物的是蒸馏水. (2)牛奶中含有丰富的“钙”,这里的“钙”指的是元素(填“单质”“元素”或“原子”). | (1)上述饮品中属于溶液的是雪碧. (2)上述饮品均能给人体提供营养素--水.水是由分子(填“元素”“分子”或“原子”)构成. |
15.下列说法正确的是( )
| A. | 洗洁精和汽油都能清洗油污,其原理不相同 | |
| B. | 酸碱中和反应生成盐和水,生成盐和水的反应不一定是中和反应 | |
| C. | 溶液结晶后溶质减少,所以饱和溶液结晶后溶质的质量分数一定减小 | |
| D. | 向久置于空气的氢氧化钠溶液中滴入酚酞试液,溶液变红,说明氢氧化钠溶液未变质 |
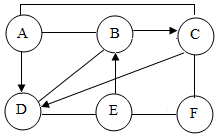 现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
 质量守恒定律的发现对化学的发展做出了重要贡献.
质量守恒定律的发现对化学的发展做出了重要贡献.