题目内容
7.标出下列各物质中有下划线元素的化合价(1)Fe2O3+3 (2)Al2(SO4)3+6 (3)NaHCO3+4 (4)BaCl2+2.
分析 根据在化合物中正负化合价代数和为零,结合各化学式进行解答本题.
解答 解:氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:2x+(-2)×3=0,则x=+3.
铝元素显+3价,设硫元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+3)×2+3y+(-2)×4×3=0,则y=+6.
钠显+1价,氢显+1价,氧元素显-2价,设碳元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+(+1)+z+(-2)×3=0,则z=+4.
氯显-1价,设钡元素的化合价是m,根据在化合物中正负化合价代数和为零,可得m+(-1)×2=0,则m=+2.
故答案为:+3;+6;+4;+2.
点评 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答.

练习册系列答案
相关题目
18.在学习氧气的制取之后,某兴趣小组探究了影响双氧水分解速度的某种因素,实验数据如下表所示,请回答下列问题:
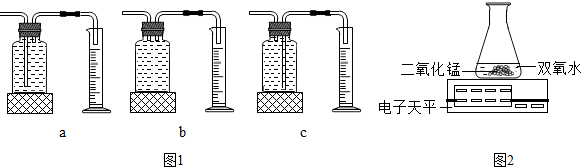
(1)本实验中制取氧气的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,应选用图一装置中的c(填编号)来收集并测量氧气的体积.
(2)分析该实验数据可得:在双氧水质量和二氧化锰的质量相等的情况下,浓度越高双氧水分解得越快.
(3)乙同学用图二装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢.

| 实验次数 | 双氧水的质量 | 双氧水的浓度 | MnO2质量 | 相同时间内产生氧气的体积(反应均未结束) |
| 1 | 50.0克 | 1% | 0.1 | 9毫升 |
| 2 | 50.0克 | 2% | 0.1 | 16毫升 |
| 3 | 50.0克 | 4% | 0.1 | 31毫升 |
(2)分析该实验数据可得:在双氧水质量和二氧化锰的质量相等的情况下,浓度越高双氧水分解得越快.
(3)乙同学用图二装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢.
15.下列对物质组成结构的认识错误的是( )
| A. | 中性原子中质子数一定等于中子数 | |
| B. | 构成物质的粒子之间一定存在间隙 | |
| C. | 酸、碱、盐的组成中,不一定都含有氢、氧元素 | |
| D. | 化学变化中分子可以再分而原子不可分 |
2.利用化学方程式计算的依据是( )
| A. | 化学方程式中,各反应物质量比等于各生成物质量比 | |
| B. | 化学方程式表示了反应物和生成物的质量关系 | |
| C. | 化学方程式表示了反应物、生成物和反应条件 | |
| D. | 化学方程式表示了一种化学反应过程 |
12.如图为氧化汞受热分解时的微观过程示意图,下列对此图分析中错误的是( )


| A. | 此反应基本类型为分解反应 | |
| B. | 构成图示中物质的粒子有分子、原子和离子 | |
| C. | 该反应的化学方程式为:2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | |
| D. | 一个氧分子由两个氧原子构成 |
19.下列有关金属的说法正确的是( )
| A. | 金属铝有很好的抗腐蚀性能 | B. | 纯铝的硬度大于铝合金 | ||
| C. | 钢是纯净物 | D. | 钢铁严重锈蚀后不值得回收 |
16.二氧化碳常用碳和氧气化合的方法制取,保持二氧化碳气体化学性质的微粒符号是( )
| A. | C和O2 | B. | C和O | C. | C和2O | D. | CO2 |
 如图是关于氢的三种原子的原子核,通过观察完成所给任务.氢的三种原子都具有相同的质子数,具有不同中子数.这三种原子统称为氢的原子.
如图是关于氢的三种原子的原子核,通过观察完成所给任务.氢的三种原子都具有相同的质子数,具有不同中子数.这三种原子统称为氢的原子.