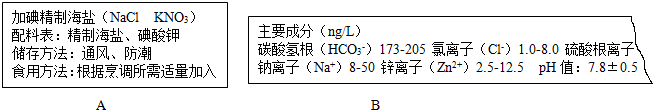
题目内容
18.在学习氧气的制取之后,某兴趣小组探究了影响双氧水分解速度的某种因素,实验数据如下表所示,请回答下列问题: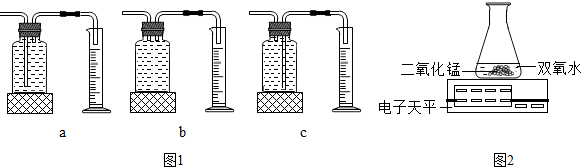
| 实验次数 | 双氧水的质量 | 双氧水的浓度 | MnO2质量 | 相同时间内产生氧气的体积(反应均未结束) |
| 1 | 50.0克 | 1% | 0.1 | 9毫升 |
| 2 | 50.0克 | 2% | 0.1 | 16毫升 |
| 3 | 50.0克 | 4% | 0.1 | 31毫升 |
(2)分析该实验数据可得:在双氧水质量和二氧化锰的质量相等的情况下,浓度越高双氧水分解得越快.
(3)乙同学用图二装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢.
分析 (1)根据双氧水在二氧化锰的催化作用下生成水和氧气以及不同的实验装置,功能不同进行解答;
(2)根据表中提供的数据可以判断影响双氧水分解速率的因素;
(3)根据单位时间内,电子天平的质量示数减少的越快,说明反应速率越快进行解答.
解答 解:(1)双氧水在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
图1装置中的c装置中,氧气通过左边导管进入瓶中,由于氧气不易溶于水,把水压入量筒中,量筒中收集的水的体积即为反应生成氧气的体积,因此本实验中,应选用图1装置中的c来测量氧气的体积.
故填:c.
(2)分析该实验数据可得:在双氧水和二氧化锰的质量相同的情况下,双氧水浓度越高,相同时间内产生氧气的体积越多,即在相同条件下,双氧水浓度越高,分解得越快.
故填:浓度越高.
(3)乙同学用图2装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢,即单位时间内电子天平的质量示数减少的越快,氧气产生的越多,双氧水分解的越快.
故填:单位时间内电子天平的质量示数减少的多少.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.将100克98%的浓硫酸,注入200克水中,则前后不发生改变的是( )
| A. | 溶液质量 | B. | 溶质的质量分数 | C. | 溶质质量 | D. | 密度 |
6.下列过程没有发生化学变化的是( )
| A. | 鲜奶变质 | B. | 木头制成桌椅 | C. | 粮食酿酒 | D. | 铁器生锈 |
10.以下是某研究小组探究影响反应速率部分因素的相关实验数据.
(1)从实验③和④对比可知,化学反应速率与温度的关系是温度越高,化学反应速率越快;
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/ml | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/S |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 12 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
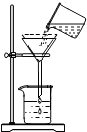 保护水土资源人人有责,为了测定一定量黄河水中泥沙的质量,某同学设计了如图所示的实验操作:
保护水土资源人人有责,为了测定一定量黄河水中泥沙的质量,某同学设计了如图所示的实验操作: