题目内容
6.在AgNO3、NaNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,过滤,洗涤,将滤渣放入盐酸中有气泡产生,则滤液中存在的阳离子是( )| A. | Cu2+和Ag+ | B. | Fe3+和Na+ | C. | Fe2+和Na+ | D. | 只有Na+ |
分析 理解金属活动性顺序,及灵活的运用有关的知识,加入铁粉可以置换出银与铜,滤渣中放入盐酸有气泡生成,则说明有铁的存在.
解答 解:根据金属的活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)Cu、Hg、Ag、Pt、Au,由于铁在钠后,不可能把钠离子从溶液中置换出来,铁在银和铜的前面,因此铁可以和硝酸银、硝酸铜反应,由于将滤渣放入盐酸中有气泡产生,说明滤渣中有过量的铁,因此在滤液中不可能再有硝酸银和硝酸铜;
故选C.
点评 主要考查了金属的活动性顺序的应用,培养学生分析问题、应用所学知识解决问题的能力.

练习册系列答案
相关题目
16. 食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
【提出问题】该脱氧剂中的黑色是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种.
【进行实验】
【得出结论】由实验①②可知,脱氧剂中黑色粉末肯定含铁粉、碳粉肯定不含铜,写出实验①过程中发生的一个相应的化学方程式Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如图所示.集气瓶的实际容积是150mL,量筒内盛100mL的水.当量筒 内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处.由上述实验数据可以算出,空气中氧气的体积分数是18%.本实验的测量结果与理论值不一致,原因可能是脱氧剂不足等.
 食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.【提出问题】该脱氧剂中的黑色是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取脱氧剂黑色粉末加入足量稀硫酸 | 粉末几乎全部溶解,只有少量黑色粉末未溶解,有气泡产生,溶液为浅绿色色 |
| ② | 实验①的残渣灼烧,将内壁有 澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如图所示.集气瓶的实际容积是150mL,量筒内盛100mL的水.当量筒 内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处.由上述实验数据可以算出,空气中氧气的体积分数是18%.本实验的测量结果与理论值不一致,原因可能是脱氧剂不足等.
17.化学实验课时,同学们正在做比较金属活动性的实验,当他们将镁条放入某FeCl3溶液中时,意外发现镁条表面有气泡产生.对于这一异常现象产生的原因,同学们设计了探究方案进行讨论.其中没有意义的是( )
| A. | 甲同学推测气体可能是H2,并收集气体用点燃法检验 | |
| B. | 乙同学继续用镁条与该FeCl3溶液反应,观察产生气泡的快慢 | |
| C. | 丙同学用锌粒与该FeCl3溶液反应,观察是否有气泡产生 | |
| D. | 丁同学猜想该FeCl3溶液呈酸性,并用pH试纸检测 |
1.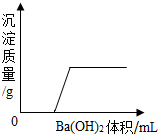 某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
 某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )| A. | HCl和MgCl2一定存在 | |
| B. | NaOH、H2SO4和MgCl2一定不存在 | |
| C. | HCl和H2SO4一定存在 | |
| D. | HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在 |
 图是某试剂瓶标签的部分内容.请回答下列问题:
图是某试剂瓶标签的部分内容.请回答下列问题: