题目内容
7.“瘦肉精”学名盐酸克伦特罗,化学式为C12H18Cl2N2O,食用含有“瘦肉精”的肉会对人体产生危害,下列对于瘦肉精认识不正确的是( )| A. | 每个瘦肉精分子中含有35个原子 | B. | 瘦肉精中碳元素的质量分数最大 | ||
| C. | 瘦肉精的相对分子质量277g | D. | 瘦肉精属于纯净物 |
分析 A、根据1个“瘦肉精”分子的构成,进行分析判断.
B、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
C、相对分子质量单位是“1”,不是“克”,常常省略不写.
D、根据瘦肉精是由瘦肉精一种物质组成的,进行分析判断.
解答 解:A、每个瘦肉精分子中含有12个碳原子、18个氢原子、2个氯原子、2个氮原子和1个氧原子构成的,则每个瘦肉精分子中含有35个原子,故选项说法正确.
B、瘦肉精中各元素的质量比为C﹕H﹕Cl﹕N﹕O=(12×12):(1×18):(35.5×2):(14×2):(16×1)=144:18:71:28:16,则瘦肉精中碳元素的质量分数最大,故选项说法正确.
C、相对分子质量单位是“1”,不是“克”,常常省略不写,故选项说法错误.
D、瘦肉精是由瘦肉精一种物质组成的,属于纯净物,故选项说法正确.
故选:C.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算等进行分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.将一定质量金属M的粉末放入盛有Cu(NO3)2溶液的烧杯中,充分反应后溶液呈无色,继续向烧杯中加入一定量的AgNO3溶液,待充分反应后过滤,得蓝色滤液和滤渣,根据实验分析有以下说法:
①金属活动性顺序:M>Cu>Ag
②滤液中一定含有M的阳离子和Cu2+
③金属M可能是Fe
④滤渣中一定含有Ag和Cu
③向滤液中滴加稀盐酸,可能产生白色沉淀
以上说法中正确的是( )
①金属活动性顺序:M>Cu>Ag
②滤液中一定含有M的阳离子和Cu2+
③金属M可能是Fe
④滤渣中一定含有Ag和Cu
③向滤液中滴加稀盐酸,可能产生白色沉淀
以上说法中正确的是( )
| A. | ①②④ | B. | ②③⑤ | C. | ③④⑤ | D. | ①②⑤ |
2.保持氢气化学性质的粒子是( )
| A. | H2O | B. | 2H | C. | H2SO4 | D. | H2 |
16.二氧化碳与二氧化硫同为非金属氧化物,某兴趣小组用类比法进行如下探究: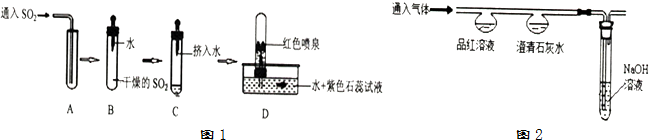
探究一:SO2的制取
(1)实验室常用固体亚硫酸钠(Na2SO3)与稀硫酸在常温下反应制取二氧化硫,选择发生装置主要应该考虑的因素是AB(填序号,可多选).
A、反应物的状态 B、反应条件 C、气体密度 D、气体溶解性
(2)探究二氧化硫性质,该兴趣小组进行了如图1所示的实验
通过上述实验,可推测SO2气体的性质有:①二氧化硫密度比空气大;②二氧化硫能溶于水.
探究二:CO2和SO2性质的比较
兴趣小组设计并进行如图2的实验,探究比较CO2和SO2的化学性质.
(3)由实验可知:
①二氧化硫能与澄清石灰水反应,生成亚硫酸钙(CaSO3)和水,写出该反应的化学方程式Ca(OH)2+SO2═CaSO3↓+H2O.
②鉴别CO2和SO2的方法是将气体分别通入品红溶液,红色褪去的是二氧化硫,无明显变化的是二氧化碳.
③实验Ⅱ中NaOH溶液的作用是吸收尾气,防止其污染空气.
探究三 测定空气中SO2的含量,探究小组进行如下实验
【查阅资料】①碘水遇淀粉变蓝色
②二氧化碳与碘水反应的化学方程式为:SO2+I2+2H2O═H2SO4+2HI(SO2、I2的相对分子质量分别为64.254)
③我国环境空气质量标准中对每次空气质量测定中SO2最高浓度限值
(4)测定步骤:
Ⅰ.检查装置的气密性
Ⅱ.向试管中加入1g溶质质量分数为0.0127%的碘水,用适量的蒸馏水稀释,再滴入2-3滴淀粉溶液,配制成稀溶液.
Ⅲ.在指定地点用注射器抽取空气140次注入上述试管中(假设每次抽气500mL)由实验可知:
①当溶液由蓝色变成无色时反应恰好完全
②由此可计算空气中SO2的含量0.46mg/m3(结果精确至0.01),所测地点的空气中SO2的含量属于二级标准(填如表中所列举的等级).

探究一:SO2的制取
(1)实验室常用固体亚硫酸钠(Na2SO3)与稀硫酸在常温下反应制取二氧化硫,选择发生装置主要应该考虑的因素是AB(填序号,可多选).
A、反应物的状态 B、反应条件 C、气体密度 D、气体溶解性
(2)探究二氧化硫性质,该兴趣小组进行了如图1所示的实验
通过上述实验,可推测SO2气体的性质有:①二氧化硫密度比空气大;②二氧化硫能溶于水.
探究二:CO2和SO2性质的比较
兴趣小组设计并进行如图2的实验,探究比较CO2和SO2的化学性质.
| 实验Ⅰ | 实验Ⅱ | |
| 通入CO2 | 通入SO2 | |
| 品红溶液 | 无明显变化 | 红色褪为无色 |
| 澄清石灰水 | 白色浑浊 | 白色浑浊 |
①二氧化硫能与澄清石灰水反应,生成亚硫酸钙(CaSO3)和水,写出该反应的化学方程式Ca(OH)2+SO2═CaSO3↓+H2O.
②鉴别CO2和SO2的方法是将气体分别通入品红溶液,红色褪去的是二氧化硫,无明显变化的是二氧化碳.
③实验Ⅱ中NaOH溶液的作用是吸收尾气,防止其污染空气.
探究三 测定空气中SO2的含量,探究小组进行如下实验
【查阅资料】①碘水遇淀粉变蓝色
②二氧化碳与碘水反应的化学方程式为:SO2+I2+2H2O═H2SO4+2HI(SO2、I2的相对分子质量分别为64.254)
③我国环境空气质量标准中对每次空气质量测定中SO2最高浓度限值
| SO2最高浓度限值(单位mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
Ⅰ.检查装置的气密性
Ⅱ.向试管中加入1g溶质质量分数为0.0127%的碘水,用适量的蒸馏水稀释,再滴入2-3滴淀粉溶液,配制成稀溶液.
Ⅲ.在指定地点用注射器抽取空气140次注入上述试管中(假设每次抽气500mL)由实验可知:
①当溶液由蓝色变成无色时反应恰好完全
②由此可计算空气中SO2的含量0.46mg/m3(结果精确至0.01),所测地点的空气中SO2的含量属于二级标准(填如表中所列举的等级).

 铜、铁、铝作为金属材料一直被广泛应用.
铜、铁、铝作为金属材料一直被广泛应用.