题目内容
10.氢氧化铷是一种可溶性碱,其化学式RbOH,则下列叙述中不正确的是( )| A. | RbOH溶液能与CO2反应 | |
| B. | RbOH溶液与硫酸反应生成的盐的化学式为RbSO4 | |
| C. | RbOH溶液能使酚酞溶液变红 | |
| D. | RbOH在水中能电离出Rb+、OH- |
分析 A.RbOH溶液具有碱的性质;
B.复分解反应中元素的化合价不变;
C.碱溶液能使无色酚酞试液变红色;
D.RbOH是强碱,在水溶液里完全电离.
解答 解:A.RbOH也是强碱,也会和非金属氧化物CO2反应,故A正确;
B、RbOH与硫酸反应生成的盐的化学式为Cs2SO4,故B错误;
C、RbOH也是强碱,在水溶液里完全电离,其水溶液呈碱性,所以滴入无色酚酞试液后溶液呈红色,故C正确;
D、Rb的金属性大于Na,NaOH是强碱,则CsOH也是强碱,在水溶液里完全电离,电离方程式为RbOH═Rb++OH-,故D正确;
故选:B.
点评 本题考查了RbOH的性质,根据碱的性质、复分解反应条件、电解质强弱等知识点来分析解答即可,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
1.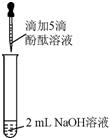 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
进行实验】
【解释与结论】
(1)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(2)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与氢氧化钠溶液的浓度有关,氢氧化钠溶液浓度过高会使酚酞退色.
 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
进行实验】
| 实验 | 实验操作 | 实验现象 |
| 1 | 向盛有2mLNa2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 |
| 2 | 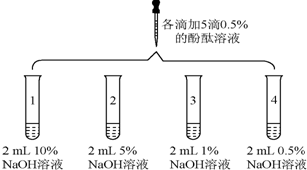 | 1号试管0.1min红色褪去 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 |
(1)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(2)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与氢氧化钠溶液的浓度有关,氢氧化钠溶液浓度过高会使酚酞退色.
5.下列各组固体,只利用水不能进行鉴别的是( )
| A. | 碳酸钠和碳酸钙 | B. | 硝酸钾和氯化钾 | C. | 硫酸铜和氯化铁 | D. | 硫酸钠和硫酸钡 |
2.某科学教师安排两组同学做测定某NaOH和Na2CO3混合物中Na2CO3质量分数的实验:
(1)第一小组利用稀盐酸测定样品中Na2CO3的质量分数,用电子天平称量数据如下表:
①写出样品与盐酸发生化学反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O.
②混合物中Na2CO3的质量分数为57%.
(2)第二组选用另一种方案测定样品(取m克)中Na2CO3的质量分数,其操作流程如下:
固体混合物$\stackrel{水}{→}$溶液$→_{操作B}^{A溶液}$BaCO3$→_{称量}^{洗涤干燥}$a克
①A是BaCl2(填化学式).该实验要求加入的A溶液必须过量,检查A溶液已经过量的方法是向澄清的滤液中滴加碳酸钠溶液,有白色沉淀产生.
②计算混合物中Na2CO3的质量分数.(写出计算步骤.)
(1)第一小组利用稀盐酸测定样品中Na2CO3的质量分数,用电子天平称量数据如下表:
| 称 量 项 目 | 质量(克) |
| 所取样品 | 9.30 |
| 锥形瓶质量 | 41.20 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部样品后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部样品后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部样品后,第三次称量的质量 | 148.30 |
②混合物中Na2CO3的质量分数为57%.
(2)第二组选用另一种方案测定样品(取m克)中Na2CO3的质量分数,其操作流程如下:
固体混合物$\stackrel{水}{→}$溶液$→_{操作B}^{A溶液}$BaCO3$→_{称量}^{洗涤干燥}$a克
①A是BaCl2(填化学式).该实验要求加入的A溶液必须过量,检查A溶液已经过量的方法是向澄清的滤液中滴加碳酸钠溶液,有白色沉淀产生.
②计算混合物中Na2CO3的质量分数.(写出计算步骤.)
19.我们知道氧气能使带火星的木条复燃,那么带火星的木条复燃是否一定需要纯氧呢?为了弄清这个问题,某化学探究小组进行了探究,步骤如下:
①取5个大小相同的集气瓶,分别编号1、2、3、4、5,并分别使瓶内留有占集气瓶容积10%、20%、30%、40%、
50%的水(余下为空气),用玻璃片盖住并倒扣于装有水的水槽中.
②分别用排水法向述5个瓶子中通入氧气,小心地把5个瓶子的水排完后,用玻璃片盖住瓶口,取出正放好.
③分别将带火星的木条伸入5个瓶中,观察到的现象如下:
请你参与探究,回答下列问题:
(1)从观察的现象可知,使带火星的木条复燃所需氧气的最小体积分数介于3号瓶与4号瓶之间.
(2)用排水法收集到氧气后,编号4瓶中氧气的体积分数约为52.6%.
(3)使用带火星木条检验氧气集满的方法是否可靠?否(填“是”或“否”).
(4)若要得到更准确的体积分数范围,只需调整①步骤中集气瓶内水的体积,并重复上述实验步骤即可.采取“半值法”探究能减少实验次数,你认为接下来实验应调整瓶内水占集气瓶容积的体积分数为35%.
①取5个大小相同的集气瓶,分别编号1、2、3、4、5,并分别使瓶内留有占集气瓶容积10%、20%、30%、40%、
50%的水(余下为空气),用玻璃片盖住并倒扣于装有水的水槽中.
②分别用排水法向述5个瓶子中通入氧气,小心地把5个瓶子的水排完后,用玻璃片盖住瓶口,取出正放好.
③分别将带火星的木条伸入5个瓶中,观察到的现象如下:
| 编号 | 1 | 2 | 3 | 4 | 5 |
| 现象 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
(1)从观察的现象可知,使带火星的木条复燃所需氧气的最小体积分数介于3号瓶与4号瓶之间.
(2)用排水法收集到氧气后,编号4瓶中氧气的体积分数约为52.6%.
(3)使用带火星木条检验氧气集满的方法是否可靠?否(填“是”或“否”).
(4)若要得到更准确的体积分数范围,只需调整①步骤中集气瓶内水的体积,并重复上述实验步骤即可.采取“半值法”探究能减少实验次数,你认为接下来实验应调整瓶内水占集气瓶容积的体积分数为35%.
 轻质碳酸镁 是制取氧化镁、颜料、油漆、日用化妆品的工业原料.
轻质碳酸镁 是制取氧化镁、颜料、油漆、日用化妆品的工业原料.