题目内容
化学老师交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质.该小组的同学进行了如下实验探究:
【提出问题】猜想I:没变质,全部是NaOH;猜想Ⅱ: :猜想Ⅲ:完全变质,只有碳酸钠
【查阅资料】已知反应:CaCl2+Na2CO3=2NaCl+CaCO3↓,碳酸钠溶液显碱性
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题.
上述步骤①中滴加过量CaCl2溶液的目的是
【实验结论】通过实验,说明上述猜想中 是正确的.
【反思】久置的氢氧化钠变质的原因是(用化学方程式表示)
通过本实验的探究,我们得到一个启示:氢氧化钠固体应该 保存.
【提出问题】猜想I:没变质,全部是NaOH;猜想Ⅱ:
【查阅资料】已知反应:CaCl2+Na2CO3=2NaCl+CaCO3↓,碳酸钠溶液显碱性
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取上述氢氧化钠固体样品加入水配成溶液,向溶液中滴加氯化钙溶液至过量,充分反应后,静置过滤. | 产生白色沉淀 | 说明久置固体中,一定含有 |
| ②取上述澄清的液体于试管,加入酚酞试液, | 酚酞试液不变色 | 说明久置固体中,一定没有 |
【实验结论】通过实验,说明上述猜想中
【反思】久置的氢氧化钠变质的原因是(用化学方程式表示)
通过本实验的探究,我们得到一个启示:氢氧化钠固体应该
考点:药品是否变质的探究,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:氢氧化钠能吸收空气中的二氧化碳变质,在检验氢氧化钠是否变质时,滴加盐酸有气泡产生.若要证明是部分变质,则先检验有碳酸钠,可以加入过量氯化钡溶液,通过产生白色沉淀来证明,通过加入过量氯化钡溶液在除去碳酸钠之后检验溶液显碱性,说明还有氢氧化钠.
解答:解:【提出问题】氢氧化钠变质有三种情况:未变质、部分变质和全部变质;
【设计方案并进行实验】
①称取上述氢氧化钠固体样品溶于水中,水配成溶液,向溶液中滴加 BaCl2 至过量,产生白色沉淀;充分反应后,静置,说明久置固体中,一定含有Na2CO3;
②取上述澄清的液体于试管,加入酚酞试液,酚酞不变色,说明久置固体中,一定不含有NaOH;①中滴加过量BaCl2溶液,是保证所取样品中的碳酸钠完全反应;
【实验结论】通过实验,证明久置固体中全部变质,只含有Na2CO3,故猜想Ⅲ是正确的;
【反思】久置的氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳发生了反应生成了碳酸钠和水,反应的方程式是:2NaOH+CO2=Na2CO3+H2O.所以氢氧化钠必须密封保存,以防变质;
故答案为:
【提出问题】部分变质:既有氢氧化钠,有含有碳酸钠;
【设计方案并进行实验】①Na2CO3;②NaOH,除去Na2CO3;
【实验结论】猜想Ⅲ;
【反思】2NaOH+CO2=Na2CO3+H2O.密封
【设计方案并进行实验】
①称取上述氢氧化钠固体样品溶于水中,水配成溶液,向溶液中滴加 BaCl2 至过量,产生白色沉淀;充分反应后,静置,说明久置固体中,一定含有Na2CO3;
②取上述澄清的液体于试管,加入酚酞试液,酚酞不变色,说明久置固体中,一定不含有NaOH;①中滴加过量BaCl2溶液,是保证所取样品中的碳酸钠完全反应;
【实验结论】通过实验,证明久置固体中全部变质,只含有Na2CO3,故猜想Ⅲ是正确的;
【反思】久置的氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳发生了反应生成了碳酸钠和水,反应的方程式是:2NaOH+CO2=Na2CO3+H2O.所以氢氧化钠必须密封保存,以防变质;
故答案为:
【提出问题】部分变质:既有氢氧化钠,有含有碳酸钠;
【设计方案并进行实验】①Na2CO3;②NaOH,除去Na2CO3;
【实验结论】猜想Ⅲ;
【反思】2NaOH+CO2=Na2CO3+H2O.密封
点评:本题考查了久置的NaOH固体是否变质的实验探究,学生明确实验现象与结论的关系,并注意结合物质的性质来分析固体变质的原因来解答本题.

练习册系列答案
相关题目

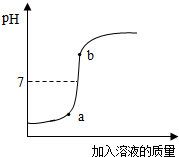 实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.
实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.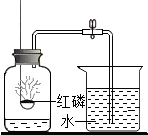 红磷燃烧除需要氧气外,还需要满足的条件是什么?
红磷燃烧除需要氧气外,还需要满足的条件是什么? 已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题:
已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题:
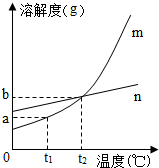 甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.
甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.