题目内容
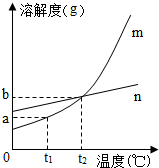 甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.
甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | 甲 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| 乙 | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
(2)若t1=10,则a为
(3)t2℃时,将40g甲物质加入到50g水中充分溶解,所得溶液是
(4)甲中含有少量的乙时,可通过
(5)检验一包白色固体是甲还是乙,你设计的实验方案是
考点:固体溶解度曲线及其作用,结晶的原理、方法及其应用,饱和溶液和不饱和溶液
专题:溶液、浊液与溶解度
分析:(1)据表格可知甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,并结合m、n的溶解度随温度变化分析解答;
(2)据(1)可知m是甲的溶解度曲线,并通过表格查找出10℃时甲的溶解度;
(3)在20℃~30℃之间时硝酸钾和氯化钾具有相同的溶解度,并据溶解度范围分析解答;
(4)据甲、乙的溶解度受温度影响情况分析解答;
(5)根据二者在20℃时溶解度的不同,取100g水,低于乙的溶解度、高于甲的溶解度的物质的质量溶解,观察现象进行判断.
(2)据(1)可知m是甲的溶解度曲线,并通过表格查找出10℃时甲的溶解度;
(3)在20℃~30℃之间时硝酸钾和氯化钾具有相同的溶解度,并据溶解度范围分析解答;
(4)据甲、乙的溶解度受温度影响情况分析解答;
(5)根据二者在20℃时溶解度的不同,取100g水,低于乙的溶解度、高于甲的溶解度的物质的质量溶解,观察现象进行判断.
解答:解:(1)据表格可知甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,而n的溶解度受温度影响较小,故n是乙的溶解度曲线;
(2)据(1)可知m是甲的溶解度曲线,通过表格可知10℃时甲的溶解度是20.9g;
(3)由图示可知:t2℃时甲、乙的溶解度相等,通过表格可知在20℃~30℃之间时甲和乙具有相同的溶解度,其取值范围是34.0g<溶解度<37.0g,即100g水中最多溶解溶质的质量在34.0g<溶解度<37.0g,所以该温度时将40g甲物质加入到50g水中充分溶解,不会完全溶解,故所得溶液是饱和溶液;
(4)甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以甲中含有少量的乙时,可通过降温结晶或冷却热饱和溶液的方法提纯甲;
(5)检验一包白色固体是甲还是乙,可根据20℃时,二者溶解度的不同设计实验:20℃时,取33g白色固体放入100g水中充分溶解,固体全部溶解的是乙,固体有剩余的是为甲;
故答案为:(1)水;(2)36.0;(3)A;(4)131.6;ACD;
(5)20℃时,取33g白色固体放入100g水中充分溶解,固体全部溶解的是乙,固体有剩余的是甲(合理均可)
(2)据(1)可知m是甲的溶解度曲线,通过表格可知10℃时甲的溶解度是20.9g;
(3)由图示可知:t2℃时甲、乙的溶解度相等,通过表格可知在20℃~30℃之间时甲和乙具有相同的溶解度,其取值范围是34.0g<溶解度<37.0g,即100g水中最多溶解溶质的质量在34.0g<溶解度<37.0g,所以该温度时将40g甲物质加入到50g水中充分溶解,不会完全溶解,故所得溶液是饱和溶液;
(4)甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以甲中含有少量的乙时,可通过降温结晶或冷却热饱和溶液的方法提纯甲;
(5)检验一包白色固体是甲还是乙,可根据20℃时,二者溶解度的不同设计实验:20℃时,取33g白色固体放入100g水中充分溶解,固体全部溶解的是乙,固体有剩余的是为甲;
故答案为:(1)水;(2)36.0;(3)A;(4)131.6;ACD;
(5)20℃时,取33g白色固体放入100g水中充分溶解,固体全部溶解的是乙,固体有剩余的是甲(合理均可)
点评:本题考查了学生依据图表和溶解度、溶质质量分数等知识分析解决问题的能力,难度不大,依据题意细心分析解答即可.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列变化不能通过一步化学反应实现的是( )
| A、Cu→Cu(OH)2 |
| B、BaCl2→BaSO4 |
| C、NaOH→Na2CO3 |
| D、H2SO4→H2O |
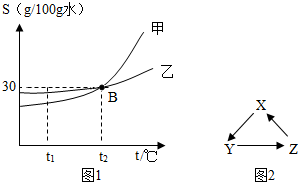 (1)如图1是甲、乙两种物质的溶解度曲线.
(1)如图1是甲、乙两种物质的溶解度曲线.