题目内容
某合作学习小组以“溶液的酸碱度及其应用”为题,开展研究性学习,请你作为该小组成员来解决以下问题:
(1)某同学说:“酸溶液呈酸性,碱溶液呈碱性,则盐溶液一定呈中性.”你认为这种推理 (填“正确”或“不正确”)
(2)从某工厂排除的废水中取出A、B两份水样,经测定,A水样pH为4.8,B水样的pH为9.2,则A水样呈 性,B水样呈 性.已知某废水中含有少量硝酸银,为收回银单质,应加入适量的 .反应方程式为: .
(1)某同学说:“酸溶液呈酸性,碱溶液呈碱性,则盐溶液一定呈中性.”你认为这种推理
(2)从某工厂排除的废水中取出A、B两份水样,经测定,A水样pH为4.8,B水样的pH为9.2,则A水样呈
考点:溶液的酸碱度测定,金属的化学性质,溶液的酸碱性与pH值的关系,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料,常见仪器及化学实验基本操作
分析:(1)盐的溶液不一定呈中性,如纯碱溶液呈碱性;
(2)PH大于7呈碱性,小于7呈酸性,等于7呈中性,要想得到银的单质可使用活动性比它强的普通金属还原制得.
(2)PH大于7呈碱性,小于7呈酸性,等于7呈中性,要想得到银的单质可使用活动性比它强的普通金属还原制得.
解答:解:(1)酸性、碱性溶液不一定是酸液、碱液,也有可能是盐溶液,如Na2CO3的水溶液呈碱性;
(2)由于PH大于7呈碱性,小于7呈酸性,等于7呈中性,所以可判断溶液的酸碱性,A水样pH为4.8<7,呈酸性,B水样的pH为9.2>7,呈碱性;要想得到银的单质可使用活动性比它强的普通金属还原制得,这里使用金属铁较为合适,因为铁是生活中用途最广泛的金属,常见易得;
铁与硝酸银反应生成硝酸亚铁和银,反应的化学方程式为:Fe+2AgNO3═Fe(NO3)2+2Ag;
故答案为:(1)不正确;
(2)酸;碱;铁粉;Fe+2AgNO3═Fe(NO3)2+2Ag.
(2)由于PH大于7呈碱性,小于7呈酸性,等于7呈中性,所以可判断溶液的酸碱性,A水样pH为4.8<7,呈酸性,B水样的pH为9.2>7,呈碱性;要想得到银的单质可使用活动性比它强的普通金属还原制得,这里使用金属铁较为合适,因为铁是生活中用途最广泛的金属,常见易得;
铁与硝酸银反应生成硝酸亚铁和银,反应的化学方程式为:Fe+2AgNO3═Fe(NO3)2+2Ag;
故答案为:(1)不正确;
(2)酸;碱;铁粉;Fe+2AgNO3═Fe(NO3)2+2Ag.
点评:解题的关键是明确指示剂与酸碱溶液的相互关系,前面的金属才能将后面的金属从其盐溶液中置换出来,碳酸钠溶液显碱性.

练习册系列答案
相关题目
目前,很多不法商贩使用“西瓜膨大增甜剂”使西瓜迅速膨大并且增甜,而这种药剂的名称叫氯吡苯脲,化学式为C12H10ClN3O,下列关于氯吡苯脲的认识正确的是( )
| A、氯吡苯脲由5种元素组成 |
| B、氯吡苯脲中元素的质量比为12:10:1:3:1 |
| C、其相对分子质量为609.5g |
| D、它是一种氧化物 |
盐酸、硫酸、硝酸的溶液都能使紫色石蕊试液变红,这是因为这些溶液中含有大量的( )
| A、氢原子 | B、氢分子 |
| C、氢离子 | D、阴离子 |
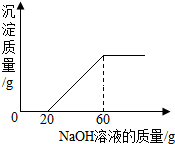 某混合溶液中含有氯化铜和稀盐酸,向其中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示:
某混合溶液中含有氯化铜和稀盐酸,向其中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示: