题目内容
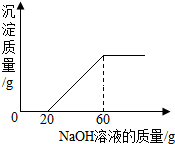 某混合溶液中含有氯化铜和稀盐酸,向其中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示:
某混合溶液中含有氯化铜和稀盐酸,向其中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示:(1)当加入的氢氧化钠溶液为20g时,所得溶液的溶质是
(2)反应最终生成的沉淀质量为
(3)当加入氢氧化钠溶液为60g时,溶液中溶质的质量是多少?(写出具体计算步骤)
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据所加入的氢氧化钠溶液一部分与稀盐酸发生中和反应生成氯化钠和水,另一部分与氯化铜反应生成氢氧化铜沉淀和氯化钠进行解答;
(2)根据图示可知氯化铜消耗氢氧化钠溶液的质量为60g-20g进行解答;
(3)根据氢氧化钠溶液的质量求出生成氯化钠的质量即可.
(2)根据图示可知氯化铜消耗氢氧化钠溶液的质量为60g-20g进行解答;
(3)根据氢氧化钠溶液的质量求出生成氯化钠的质量即可.
解答:解:(1)当加入的氢氧化钠溶液为20g时,氢氧化钠溶液恰好与盐酸反应生成氯化钠和水,而氯化铜没有反应,所以所得溶液的溶质是CuCl2和NaCl;故填:CuCl2和NaCl;
(2)根据图示可知氯化铜消耗氢氧化钠溶液的质量为60g-20g=40g,设生成氢氧化铜的质量为x,生成氯化钠的质量为y.
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
80 98 117
40g×20% x y
=
x=9.8g
=
y=11.7g
故答案为:9.8g;
(3)由关系图可知,与混合溶液中盐酸发生反应的氢氧化钠溶液的质量为20g,其中氢氧化钠的质量=20g×20%=4g;
设反应生成氯化钠的质量为z
NaOH+HCl═NaCl+H2O
40 58.5
4g z
=
z=5.85g
溶液中溶质的质量=5.85g+11.7g=17.55g
答:溶液中溶质的质量为17.55g.
(2)根据图示可知氯化铜消耗氢氧化钠溶液的质量为60g-20g=40g,设生成氢氧化铜的质量为x,生成氯化钠的质量为y.
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
80 98 117
40g×20% x y
| 80 |
| 40g×20% |
| 98 |
| x |
x=9.8g
| 80 |
| 40g×20% |
| 117 |
| y |
y=11.7g
故答案为:9.8g;
(3)由关系图可知,与混合溶液中盐酸发生反应的氢氧化钠溶液的质量为20g,其中氢氧化钠的质量=20g×20%=4g;
设反应生成氯化钠的质量为z
NaOH+HCl═NaCl+H2O
40 58.5
4g z
| 40 |
| 4g |
| 58.5 |
| z |
z=5.85g
溶液中溶质的质量=5.85g+11.7g=17.55g
答:溶液中溶质的质量为17.55g.
点评:在对表示反应过程的曲线进行分析时,该曲线的起点表示氢氧化钠恰好与盐酸完全反应,曲线的折点为与氯化铜恰好完全反应.

练习册系列答案
相关题目
绿茶中含有的单宁酸(化学式为C76H52O46)具有抑制血压上升、清热解毒等功效.下列有关单宁酸的说法正确的是( )
| A、是化合物中的氧化物 |
| B、完全燃烧产物均为氧化物 |
| C、氧元素的质量分数最小 |
| D、由碳、氢、氧原子构成 |
2011年科学家发现了一种新型火箭燃料N(NO2)3(三硝基胺).下列有关叙述判断错误的是( )
| A、N(NO2)3中氮元素的化合价为+2 |
| B、N(NO2)3的相对分子质量为152 |
| C、N(NO2)3中氮元素和氧元素的质量比为7:12 |
| D、N(NO2)3中氮元素的质量分数为36.84% |


 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据图回答:
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据图回答: