题目内容
15.素有“铜都”之称的安徽铜陵有许多黄铜矿(主要成分为CuFeS2).黄铜矿经初步处理后,所得溶液甲中的溶质有Fe2(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取硫酸亚铁晶体(化学式为FeSO4•7H2O)并回收铜.主要步骤如图所示: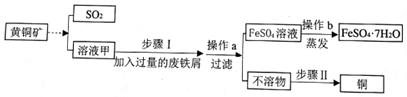
(1)溶液甲呈酸性(填“酸性”、“碱性”或“中性”).
(2)步骤Ⅰ中Fe2(SO4)3与加入的废铁屑反应的化学方程式:Fe2(SO4)3+Fe=3FeSO4,该反应的基本类型为化合反应.废铁屑含有少量铁锈,对产物的成分没有影响,原因是硫酸能与铁锈反应生成硫酸铁,铁与硫酸铁反应生成硫酸亚铁.
(3)操作b中使用玻璃棒的作用是使液体受热均匀,防止液体飞溅.
(4)不溶物的成分为Fe、Cu(填化学式),步骤Ⅱ中要加入的试剂是硫酸.
(5)SO2直接排放到大气中造成的环境污染后果是形成酸雨,污染环境.
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)所得溶液甲中的溶质有Fe2(SO4)3、CuSO4及H2SO4.由于含有硫酸,所以溶液甲呈酸性.
(2)步骤Ⅰ中Fe2(SO4)3与加入的废铁屑反应的化学方程式:Fe2(SO4)3+Fe=3FeSO4,形式上为多变一,为化合反应.废铁屑含有少量铁锈,由于最终要获得硫酸亚铁,而硫酸能与铁锈反应生成硫酸铁,铁与硫酸铁反应生成硫酸亚铁,所以对产物的成分没有影响.
(3)蒸发操作中使用玻璃棒的作用是 使液体受热均匀,防止液体飞溅.
(4)不溶物的成分为 Fe、Cu(填化学式).要除去铁,而最终过程要制得的是硫酸亚铁,所以步骤Ⅱ中要加入的试剂是硫酸,这样得到的硫酸亚铁可以回收制得产品硫酸亚铁晶体(化学式为FeSO4•7H2O).
(5)SO2直接排放到大气中造成的环境污染后果是 形成酸雨,污染环境.
故答案为:
(1)酸性.
(2)化合反应. 硫酸能与铁锈反应生成硫酸铁,铁与硫酸铁反应生成硫酸亚铁.
(3)使液体受热均匀,防止液体飞溅.
(4)Fe、Cu; 硫酸.
(5)形成酸雨,污染环境.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
5.以下归纳和总结完全正确的一组是( )
| A、对酸的认识 | B、对碱的认识 |
| ①酸溶液中都存在H+ ②人体胃液中含有硫酸帮助消化 ③酸雨的pH小于5.6 | ①碱溶液中都存在OH- ②氢氧化钠俗称烧碱、纯碱 ③氨水可以作为氮肥使用 |
| C、对盐的认识 | D、对有机物的认识 |
| ①盐溶液都是中性的 ②碳酸盐加稀盐酸都会产生CO2 ③食用加碘盐可以预防甲状腺肿大 | ①有机物都含有碳元素 ②甲烷是最简单的有机物 ③淀粉属于有机高分子化合物 |
| A. | A | B. | B | C. | C | D. | D |
6.物质的性质决定用途,下列说法不正确的是( )
| A. | 用盐酸除去铁钉表面的铁锈 | B. | 氢氧化钙可用作建筑材料 | ||
| C. | 碳酸氢钠可以治疗胃酸过多 | D. | 浓硫酸可以作食品干燥剂 |
10.由SO2、SO3组成的混合气体,经分析混合气体中硫元素的质量分数为48%,则混合气体中SO2、SO3的质量比为( )
| A. | 6:5 | B. | 4:1 | C. | 4:5 | D. | 5:1 |
20.实验是化学的基础,物质的分离、除杂、检验和鉴别是化学实验的重要环节.下面实验设计不能达到实验目的是( )
| 实验目的 | 实验设计 | |
| A | 将铁粉和铜粉分离 | 用磁铁吸引 |
| B | 除去水中含有的杂质 | 沉淀、过滤、吸附、蒸馏 |
| C | 检验二氧化碳 | 将气体通入澄清石灰水 |
| D | 鉴别盐酸、NaCl溶液和NaOH溶液 | 分别向三种溶液中滴加几滴无色酚酞 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
7.在实验室进行粗盐提纯的溶解、过滤和蒸发三个操作步骤中,都要用到玻璃棒,而使用玻璃棒的目的与下列叙述无关的是( )
| A. | 加速溶解 | B. | 引流 | C. | 加快蒸发 | D. | 防止液体溅出 |
 如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动.杠杆两端分别悬挂等质量、等体积的金属锌球,此时杠杆平衡.再将铁球同时分别浸没到密度相同的稀硫酸和硫酸铜溶液中.反应一段时间后会观察到:
如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动.杠杆两端分别悬挂等质量、等体积的金属锌球,此时杠杆平衡.再将铁球同时分别浸没到密度相同的稀硫酸和硫酸铜溶液中.反应一段时间后会观察到: 如图是元素周期表中的一部分信息,请回答:
如图是元素周期表中的一部分信息,请回答: ,则磷元磷位于元素周期表的第三周期;
,则磷元磷位于元素周期表的第三周期;