题目内容
12.溶液与人类的生活息息相关,溶液的配制是日常生活和科学实验中的常见操作.下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).| 溶液中溶质的质量分数/% | 4 | 12 | 16 | 24 | 28 |
| 硫酸溶液的密度/g/mL | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/g/mL | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(1)取12%的硫酸溶液100毫升可配制成6%的硫酸溶液多少克?
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
分析 (1)根据溶液稀释前后溶质质量不变进行分析;
(2)根据先要求出氨水的溶质质量分数,再利用密度的公式即可求算出溶液的体积.
解答 解:(1)可配制成6%的硫酸溶液质量为:$\frac{100mL×1.08g/mL×12%}{6%}$=216g;
(2)200毫升28%的氨水质量为:200mL×0.9g/mL=180g,加入240毫升水,也就是向氨水中加入240g水后,氨水的质量变为420g,此时的质量分数为:$\frac{180g×28%}{420g}×100%$=12%,所以所得溶液体积是$\frac{420g}{0.95g/mL}$=442.1mL.
故答案为:(1)216g;
(2)442.1mL.
点评 记住溶质质量分数的计算并会应用,知道溶液在稀释前后溶质的质量不变,所以要使溶液的质量分数减小一半,可以加入与原溶液质量相等的水即可达到目的.

练习册系列答案
相关题目
2.正确的实验操作是科学探究的关键.下列实验操作正确的是( )
| A. |  过滤浑浊液体 | B. |  取用大理石 | C. |  排水法收集O2 | D. |  滴管的使用 |
3.除去下列物质中的少量杂质(括号内),所选用的试剂错误的是( )
| A. | FeCl2(CuCl2) 铁粉 | B. | CO2(CO) 石灰水 | ||
| C. | NaCl(Na2CO3) 稀盐酸 | D. | Cu(CuO) 一氧化碳 |
20.根据下图提供的信息判断,下列说法正确的是( )


| A. | 钠原子的结构示意图中,x=10 | |
| B. | 在元素周期表中,钠元素的原子序数为11 | |
| C. | 在化学反应中,氯原子容易失去电子 | |
| D. | 氯化钠是由氯化钠离子构成的 |
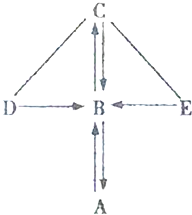 如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略).
如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略). 请用所学化学知识解释下列原理.
请用所学化学知识解释下列原理. 科学家最近在低温下合成了一种化合物,其分子模型如图所示,其中“
科学家最近在低温下合成了一种化合物,其分子模型如图所示,其中“ ”代表碳原子,“
”代表碳原子,“ ”代表氢原子.
”代表氢原子.