题目内容
7.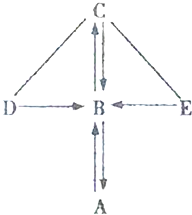 如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略).
如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略).(1)D的化学式为H2SO4
(2)B→C的化学方程式为CaO+H2O═Ca(OH)2
(3)C-E的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,该反应能够发生的理由是能够产生不溶于水的碳酸钙.
分析 点燃条件下,氧气和氢气反应生成水,电解水能够生成氢气和氧气;
硫酸中含有氧元素,稀硫酸在工业中可以用于除锈;
稀硫酸能和氢氧化钙反应生成硫酸钙和水;
水能和氧化钙反应生成氢氧化钙;
氢氧化钙能和碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠;
碳酸钠和稀盐酸或稀硫酸反应能够产生水.
解答 解:点燃条件下,氧气和氢气反应生成水,电解水能够生成氢气和氧气;
硫酸中含有氧元素,稀硫酸在工业中可以用于除锈;
稀硫酸能和氢氧化钙反应生成硫酸钙和水;
水能和氧化钙反应生成氢氧化钙;
氢氧化钙能和碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠;
碳酸钠和稀盐酸或稀硫酸反应能够产生水,因此ABCDE可以是氧气、水、氢氧化钙、硫酸和碳酸钠,它们属于不同类别的物质;
(1)D是硫酸,硫酸的化学式为H2SO4.
故填:H2SO4.
(2)水和氧化钙反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.
故填:CaO+H2O═Ca(OH)2.
(3)氢氧化钙能和碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,该反应能够发生的理由是能够产生不溶于水的碳酸钙.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;能够产生不溶于水的碳酸钙.
点评 本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.关于木炭与一氧化碳的说法中,错误的一项是( )
| A. | 都具有可燃性可作燃料 | |
| B. | 在氧气中完全燃烧的产物相同 | |
| C. | 都具有还原性能够冶炼金属 | |
| D. | 与氧化铜发生的反应都属于置换反应 |
2.某中学化学活动小组的同学对附近一家造纸厂排放的污水中氢氧化钠的含量用如下方法进行了测定,取80g污水于烧杯中,逐滴加入配制好的20%稀硫酸至恰好完全反应(假设污水中的其他成分不与稀硫酸反应),为减小实验误差,他们重复做了3次实验,稀硫酸的用量如下表所示:
(1)实验中与污水恰好完全反应所需要的稀硫酸的质量为49g
(2)计算污水中所含氢氧化钠的质量分数.
| 实验次数 | 1 | 2 | 3 |
| 加入稀硫酸的质量/g | 48 | 49 | 50 |
(2)计算污水中所含氢氧化钠的质量分数.
12.溶液与人类的生活息息相关,溶液的配制是日常生活和科学实验中的常见操作.下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).
请仔细分析后回答下列问题:
(1)取12%的硫酸溶液100毫升可配制成6%的硫酸溶液多少克?
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
| 溶液中溶质的质量分数/% | 4 | 12 | 16 | 24 | 28 |
| 硫酸溶液的密度/g/mL | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/g/mL | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(1)取12%的硫酸溶液100毫升可配制成6%的硫酸溶液多少克?
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
19.下列反应既是复分解反应,又是中和反应的是( )
| A. | BaCl2+H2SO4═BaSO4↓+2HCl | B. | Mg(OH)2+2HCl=MgCl2+2H2O | ||
| C. | CuO+H2SO4=CuSO4+H2O | D. | SO2+2NaOH=Na2SO3+H2O |
6.鉴别稀盐酸和稀硫酸可选用的试剂是( )
| A. | AgNO3溶液 | B. | 紫色石蕊溶液 | C. | Fe | D. | BaCl2溶液 |
7.5.6g含杂质的铁粉和足量稀盐酸反应,生成0.18g氢气,则铁粉中含有的杂质不可能是( )
| A. | Mg | B. | Zn | C. | Cu | D. | Ag |
