题目内容
9.在“质量守恒定律”的课堂教学中,老师引导同学们进行反应物与生成物的质量关系”的实验探究.如图实验装置和选用药品,现分别标以A、B、C表示如图:
A、B、C三个实验分别由甲、乙、丙三个组的同学来完成,D实验由丁组同学对镁条燃烧前后分别进行称量,他们都进行了规范的操作、准确的称量和细致的观察.
(1)甲组同学观察到的实验现象是:产生大量的白烟,放出大量的热,装置中气球的作用是:缓冲作用.
(2)丙组同学认为C实验说明了质量守恒定律.其反应的化学方程式为2NaOH+CuSO4=Na2SO4+Cu(OH)2↓.从原子的角度说明原因化学反应的过程是反应物的原子重新组合的过程,反应前后原子的种类、数目、质量不变,因此生成物的质量也不会改变.
(3)乙、丁两组同学得到的结论是:实验B、D均说明质量不守恒.你认为此结论错误(填“正确”或“错误”),你认为B实验天平不平衡的原因是反应时产生的二氧化碳气体扩散到空气中,剩余物的质量减少,而D实验中反应后质量增加,原因是反应时有气体参与,所以剩余质量增加,要想用这两个实验验证质量守恒定律,需做的改进是在密闭容器内进行.
分析 (1)根据白磷燃烧放热分析;
(2)根据氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,质量守恒定律的微观实质分析质量守恒的原因;
(3)根据B、D实验减少的物质分析天平不平衡的原因;有气体参加或生成的反应的实验应在密闭容器内进行;
解答 解:(1)磷在空气中燃烧,产生大量的白烟,放出大量的热.为防止白磷燃烧产生的热量把橡皮塞冲出,因此加一个小气球,起到缓冲的作用;
(2)氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓.C实验说明了质量守恒定律,因为化学反应的过程是反应物的原子重新组合的过程,反应前后原子的种类、数目、质量不变,因此生成物的质量也不会改变;
(3)实验中盐酸与碳酸钠反应生成了氯化钠、水、二氧化碳,生成的二氧化碳跑到了空气中,使剩余物质质量减少、D实验镁条燃烧是镁与氧气反应生成氧化镁,有气体参与,所以剩余质量增加;有气体参加或生成的反应的实验应在密闭容器内进行;
答案:(1)产生大量的白烟,放出大量的热;缓冲作用;
(2)2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;化学反应的过程是反应物的原子重新组合的过程,反应前后原子的种类、数目、质量不变,因此生成物的质量也不会改变;
(3)错误;反应时产生的二氧化碳气体扩散到空气中,剩余物的质量减少;反应时有气体参与,所以剩余质量增加;在密闭容器内进行.
点评 本题考查了质量守恒定律的验证方法的探究,对于有气体参加反应或有气体生成的反应需要在密闭容器中进行,还要能够从微观的角度对质量守恒定律进行解释.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
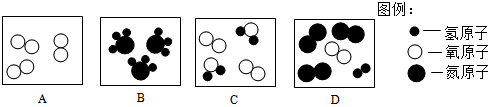
17.如图为某反应的微观模拟示意图.从图中获得的有关信息不正确的是( )


| A. | 原子是化学变化中的最小粒子 | B. | 化学反应前后原子的数目没有增减 | ||
| C. | 分子间存在一定的间隙 | D. | 该化学反应属于分解反应 |
4.某同学用量筒量取30mL水时仰视,然后俯视倒出一部分水至20mL,则倒出的水的体积( )
| A. | 等于10mL | B. | 大于10mL | C. | 小于10mL | D. | 无法确定 |
1.镁带在空气中充分燃烧,在该反应中,镁、氧气、氧化镁的质量比为( )
| A. | 2:1:2 | B. | 24:32:40 | C. | 48:32:80 | D. | 48:16:64 |
18.从水分子分解示意图中我们能获得许多信息,其中描述正确的是( )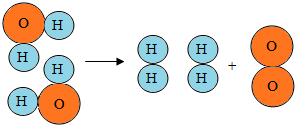

| A. | 这是一个化合反应 | |
| B. | 在化学变化中氢原子和氧原子是最小的粒子 | |
| C. | 水是由氢气和氧气组成的 | |
| D. | 在化学变化中氢分子和氧分子都没有发生变化 |
19.化学与人体健康密切相关.市场上有“高钙牛奶”、“加氟牙膏”、“葡萄糖酸锌”商品,这里的“钙、氟、锌”应理解为( )
| A. | 原子 | B. | 元素 | C. | 分子 | D. | 单质 |

 小红家从农贸市场买回一包化肥,化肥包装上的标签如图所示,请回答下列问题.
小红家从农贸市场买回一包化肥,化肥包装上的标签如图所示,请回答下列问题.