题目内容
14.过氧化钙晶体[CaO2•8H2O]较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒.以贝壳为原料制备CaO2流程如下: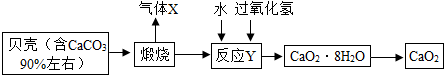
(1)气体X的化学式是CO2
(2)反应Y需控制温度在0~5℃,可将反应容器放在C中,
A.水B.冰C.冰水混合物D.室温环境
(3)该反应是化合反应,反应物是CaO2•8H2O,请写出该反应的化学方程式CaO+7H2O+H2O2=CaO2•8H2O,获得的过氧化钙晶体中含有Ca(OH)2杂质.原因是氧化钙能和水反应生成氢氧化钙.
分析 (1)高温条件下,碳酸钙分解生成氧化钙和二氧化碳;
(2)冰水混合物的温度是0℃;
(3)氧化钙和水、过氧化氢反应生成过氧化钙晶体;
水和氧化钙反应生成氢氧化钙.
解答 解:(1)气体X是碳酸钙分解生成的二氧化碳,二氧化碳的化学式是CO2.
故填:CO2.
(2)反应Y需控制温度在0~5℃,可将反应容器放在冰水混合物中.
故填:C.
(3)氧化钙和水、过氧化氢反应生成过氧化钙晶体,该反应的化学方程式为:CaO+7H2O+H2O2=CaO2•8H2O;
获得的过氧化钙晶体中含有Ca(OH)2杂质.原因是氧化钙能和水反应生成氢氧化钙.
故填:CaO+7H2O+H2O2=CaO2•8H2O;氧化钙能和水反应生成氢氧化钙.
点评 本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.一些食物的近似PH如表:
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用上述食物中的( )
| 食 物 | 苹 果 | 葡 萄 | 牛 奶 | 玉米粥 |
| pH | 2.9-3.3 | 3.5-4.5 | 6.3-6.6 | 6.8-8.0 |
| A. | 苹果 | B. | 葡萄 | C. | 牛奶 | D. | 玉米粥 |
5.某校研究性学习活动小组利用课余时间调查雾霾产生的原因,并提出可减少的雾霾说法正确的是( )
| A. | 鼓励开私家车出行 | B. | 鼓励使用太阳能热水器 | ||
| C. | 鼓励用煤火力发电 | D. | 鼓励露天焚烧垃圾 |
6.2015年冬全圈大范围的雾霾天气增多,雾霾是一种大气污染现象,下列不属于雾覆治理措施的是( )
| A. | 植树造林 | B. | 提倡绿色出行,发展公共交通 | ||
| C. | 外出时佩戴防雾霾口罩 | D. | 减少燃煤发电,增加太阳能发电 |


 某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验: