题目内容
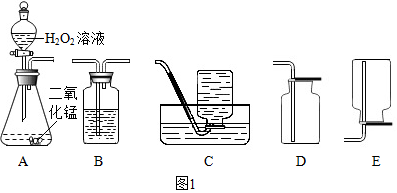
8.在“质量守恒定律”的教学中,老师引导同学们进行如图1“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题:
(1)如图1A、B所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上.
①A瓶重新放回到天平上,天平能(填“能”或“不能”)保持平衡.
②B瓶重新放回到天平上,天平能否保持平衡?不能,理由是反应生成的二氧化碳从容器中逸出.
③从原子的角度分析“质量守恒定律”反应前后原子种类、总个数和质量都不变.
(2)如图C所示,用细线系住铜棒使之平衡,然后在铜棒一端用酒精灯加热.铜在加热的条件下,能与空气中的氧气反应生成氧化铜.
①写出铜在空气中加热的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
②加热一段时间后,铜棒不能(填“能”或“不能”)保持平衡,理由是铜棒加热的一端和空气中的氧气反应生成了氧化铜.
(1)图2是甲、乙两组同学分别设计的质量守恒定律的两个验证实验.请根据图示进行思考回答(假设甲、乙两组药品混合前质量均为m前、混合后质量均为m后):
①甲组药品混合前、后质量关系为:m前>m后,请解释原因反应生成的二氧化碳气体逸出,该实验若试剂不变,应如何改进此装置使反应在密闭容器中进行;
②乙组药品混合前、后质量关系为:m前=m后,乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,原因是硝酸钠不能和氯化钡反应.
分析 化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
化学反应前后,元素的种类不变,原子的种类、总个数和质量不变.
解答 解:(1)①A瓶中,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,没有物质逸出,逸出重新放回到天平上时,天平能保持平衡.
故填:能.
②B瓶重新放回到天平上,天平不能保持平衡,这是因为稀盐酸和碳酸钙反应生成的二氧化碳气体逸出,因此B瓶重新放回到天平上时,天平指针向右偏转.
故填:不能;反应生成的二氧化碳从容器中逸出.
③从原子的角度分析“质量守恒定律”是因为反应前后原子种类、总个数和质量都不变.
故填:反应前后原子种类、总个数和质量都不变.
(2)①铜在空气中加热时,能和空气中的氧气反应生成氧化铜,反应的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
故填:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
②加热一段时间后,铜棒不能保持平衡,这是因为铜棒加热的一端和空气中的氧气反应生成了氧化铜,导致铜棒左重右轻,从而失去平衡.
故填:不能;铜棒加热的一端和空气中的氧气反应生成了氧化铜.
(1)①甲组药品混合前、后质量关系为:m前>m后,这是因为稀盐酸和碳酸钠反应生成的二氧化碳气体逸出;
该实验若试剂不变,改进此装置的方法可以是使反应在密闭容器中进行.
故填:反应生成的二氧化碳气体逸出;使反应在密闭容器中进行.
②乙组药品混合前、后质量关系为:m前=m后,乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,这是因为硝酸钠不能和氯化钡反应,不能用来验证质量守恒定律.
故填:硝酸钠不能和氯化钡反应.
点评 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.

| A. | 用氢氧化钠溶液吸收二氧化硫 | |
| B. | 用加水的方法区分烧碱和食盐两种固体 | |
| C. | 用点燃的方法区分涤纶和羊毛 | |
| D. | 用点燃的方法除去混在CO2中的CO |
| A.化学常识 | B.化学与安全 |
| 空气的主要成分--氮气和氧气 硬水和软水--用肥皂水来检验 | 居室装修--常开窗通风,使有害物挥发 煤气泄漏--关闭气阀、打开排气扇电源开关 |
| C.化学与材料 | D.化学与环境 |
| 不锈钢汤勺--合金 聚乙烯塑料--有机合成材料 | 减少水污染--合理使用农药化肥 减少酸雨的发生--使用新型能源 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
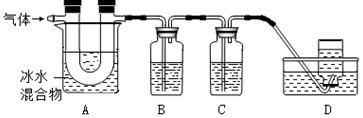
①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).
 水是人们生活生产中应用最多的物质:
水是人们生活生产中应用最多的物质: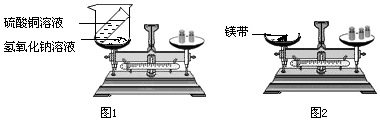




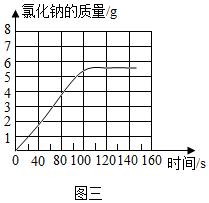 .
.