题目内容
13.同学们为了探究物质发生化学反应前后总质量是否改变,分别设计了下面两个实验: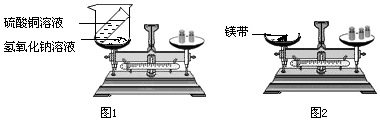
(1)甲组同学利用图1所示的实验进行探究.
把盛有适量硫酸铜溶液的小试管放入盛有氢氧化钠溶液的烧杯中,将烧杯放在托盘天平上,用砝码平衡.取下烧杯,将硫酸铜溶液小心倒入烧杯中,烧杯中出现的现象是产生蓝色沉淀然后把烧杯连同试管再放回天平上,天平仍然平衡.根据实验得出的结论是化学反应前后物质的总质量不变
(2)乙组同学利用图2所示的实验进行探究.
取一根用砂纸打磨干净的长镁带和一个石棉网,将它们一起放在托盘天平上,用砝码平衡.取下石棉网,在石棉网上方点燃镁带,发生反应的化学方程式为2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO.燃烧结束后将所得的物质与石棉网一起再放回托盘天平上称量,意外发现质量减轻了.请你分析产生这一现象的原因可能是部分生成物以白烟形式逸散到空气中.
分析 化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
化学反应前后,元素的种类不变,原子的种类、总个数和质量不变.
解答 解:(1)硫酸铜和氢氧化钠反应生成蓝色沉淀氢氧化铜和硫酸钠,由于反应前后元素种类不变,原子种类、总个数和质量都不变,因此反应前后总质量不变,将硫酸铜溶液小心倒入烧杯中,烧杯中出现的现象是产生蓝色沉淀,然后把烧杯连同试管再放回天平上,天平仍然平衡.根据实验得出的结论是化学反应前后物质的总质量不变.
故填:产生蓝色沉淀;化学反应前后物质的总质量不变.
(2)镁在空气中燃烧生成氧化镁,燃烧过程中,产生大量白烟,产生的白烟是生成的氧化镁固体,在石棉网上方点燃镁带,发生反应的化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
燃烧结束后将所得的物质与石棉网一起再放回托盘天平上称量,意外发现质量减轻了,产生这一现象的原因可能是部分生成物以白烟形式逸散到空气中.
故填:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;部分生成物以白烟形式逸散到空气中.
点评 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
1.下列各组离子在pH=1的硫酸溶液中能大量共存的是( )
| A. | Na+、Cl-、OH- | B. | NO3-、Mg2+、Cu2+、CO32- | ||
| C. | Ag+、Na+、Cl- | D. | K+、Ca2+ |
2.分类是学习和研究物质的一种常见的方法,下列物质的分类正确的是( )
| A. | 冰和水是一种物质,属于单质 | |
| B. | 氯酸钾中含有氧元素,属于氧化物 | |
| C. | 硫酸铜中含有硫酸根离子,但属于酸 | |
| D. | 纯碱溶液呈碱性,但纯碱属于盐 |
1.下列有关分子、原子和离子的说法正确的是( )
| A. | 分子是保持物质性质的一种粒子 | |
| B. | 物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变 | |
| C. | 分子、原子、离子都可以直接构成物质 | |
| D. | 在化学反应中,任何离子都不能再分 |
18.在化学实验室,小刚和小强意外发现实验桌上有一瓶敞口放置的氢氧化钠固体,他们对这瓶氢氧化钠固体是否变质进行了如下实验探究:
【提出问题】这瓶氢氧化钠固体是否变质?
【实验探究】为检验这瓶氢氧化钠固体是否变质,小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质.
小强:取少量样品加适量蒸馏水配成溶液后,滴入适量澄清石灰水,若观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质.
(1)你认为上述实验方案错误的是小刚:理由是碳酸钠溶液显碱性,也能使酚酞试液变红色.
请你设计另外一个方案,证明该瓶氢氧化钠固体已经变质,并完成以下实验报告:
(2)【交流反思】在实验室里氢氧化钠需要密封保存.药品密封保存的原因很多,请你写出浓硫酸需要密封保存的原因浓硫酸能吸收水蒸气.
【提出问题】这瓶氢氧化钠固体是否变质?
【实验探究】为检验这瓶氢氧化钠固体是否变质,小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质.
小强:取少量样品加适量蒸馏水配成溶液后,滴入适量澄清石灰水,若观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质.
(1)你认为上述实验方案错误的是小刚:理由是碳酸钠溶液显碱性,也能使酚酞试液变红色.
请你设计另外一个方案,证明该瓶氢氧化钠固体已经变质,并完成以下实验报告:
| 实验步骤 | 实验现象及结论 |
| 取少量样品加适量蒸馏水配成溶液后,滴入适量氯化钙溶液 | 观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质 |
5.元素钴(Co)有多种化合价,将11.9gCoCO3在纯净氧气中加热可得到8.3g钴的氧化物,则CoCO3在纯氧中受强热发生反应的化学方程式是( )
| A. | CoCO3+O2$\frac{\underline{\;强热\;}}{\;}$CoCO2+CO2 | B. | 2CoCO3+O2$\frac{\underline{\;强热\;}}{\;}$2CoCO2+2CO2 | ||
| C. | 4CoCO3+O2$\frac{\underline{\;强热\;}}{\;}$2Co2O3+4CO2 | D. | 4CoCO2+3O2$\frac{\underline{\;强热\;}}{\;}$2Co2O3+4CO2 |
2.下列物质的性质与用途的对应关系错误的是( )
| 选项 | 性质 | 用途 |
| A | 氢氧化钙溶液呈碱性 | 改良酸性土壤 |
| B | 稀盐酸能与某些金属氧化物反应 | 除铁锈 |
| C | 浓硫酸具有脱水性 | 实验室干燥气体 |
| D | 氢氧化钠能与某些非金属氧化物反应 | 吸收二氧化硫 |
| A. | A | B. | B | C. | C | D. | D |

 A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).请回答下列问题:
A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).请回答下列问题: