题目内容
5.实验室要配制100g溶质质量分数为16%的氯化钠溶液.(1)步骤:
①计算:需要氯化钠的质量16g;
②称量固体氯化钠,量取一定体积的水;
③溶解;
④装瓶、贴标签;试剂瓶的标签上应体现的信息是NaCl溶液,16%.
(2)下列操作导致配出来的溶液溶质质量分数偏大的有C.
A.称量时,左砝右物; B.氯化钠没有全部溶解;
C.量取水时,俯视观察; D.溶液装瓶时,部分液体流出.
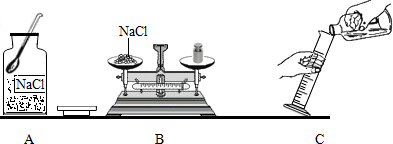
(3)如图操作正确的是C(填序号).
(4)若要将配成的100g16%氯化钠溶液,稀释成5%的氯化钠溶液,需加水220mL.
分析 (1)①根据公式:溶质质量=溶液质量×溶质质量分数去求;
②从配制一定溶质质量分数的溶液.其步骤应为:计算、称量、量取、溶解去分析;
④从标签上标明的信息应包括溶液名称和溶质的质量分数去分析;
(2)A、从用托盘天平称量药品的质量时,应把药品放在左盘,题目中放反了,此时药品的质量=砝码质量-游码质量,由于题目中称取16g氯化钠,没有用到游码,故质量不变,即对溶液没的影响去分析;
B、从氯化钠没有全部溶解,由于没有溶解的氯化钠不能算做溶质去分析;
C、从量取水时,如果俯视则会使读数偏大,造成实际量取水的体积偏小去分析;
D、从溶液具有均一性去分析.
(3)A、从瓶塞没有倒放去分析;
B、从称量药品时,要在两盘各放一张质量相同的纸去分析;
C、从取用液体药品的方法去分析;
(4)根据稀释原则:稀释前后溶质的质量不变,列式计算即可.
解答 解:(1)①根据公式:溶质质量=溶液质量×溶质质量分数.故所需氯化钠的质量为:100g×16%=16g;故答案为:16;
②配制一定溶质质量分数的溶液.其步骤应为:计算、称量、量取、溶解;故答案为:溶解;
④标签上标明的信息应包括溶液名称和溶质的质量分数;故答案为:NaCl溶液,16%;
(2)A、用托盘天平称量药品的质量时,应把药品放在左盘,题目中放反了,此时药品的质量=砝码质量-游码质量,由于题目中称取16g氯化钠,没有用到游码,故质量不变,即对溶液没的影响;故错误;
B、氯化钠没有全部溶解,由于没有溶解的氯化钠不能算做溶质,即溶质量质量变小,根据公式:溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%,可以看出溶液中溶质的质量分数会变小;故错误;
C、量取水时,如果俯视则会使读数偏大,造成实际量取水的体积偏小,即溶液的质量会变小,由公式:溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%,可知质量分数会变大;故正确;
D、由于溶液具有均一性,所以溶液装瓶时,部分液体流出,溶质的质量分数不会改变;故错误.
故答案为:C;
(3)A、瓶塞没有倒放;故错误;
B、由于化学药品许多是有腐蚀性的,为防止腐蚀托盘,称量药品时,要在两盘各放一张质量相同的纸,图中没有;故错误;
C、取用液体药品时应注意:①瓶塞倒放,②标签对准手心,③瓶口紧挨试管口,④倒完液体后立即盖紧瓶塞,并把试剂瓶放回原处;图中没有错误;故正确;
故答案为:C;
(4)设:将配成的100g16%氯化钠溶液,稀释成5%的氯化钠溶液,需加水的质量为x,
根据稀释原则:稀释前后溶质的质量不变.
100g×16%=(100g+x)×5%
解之得:
x=220g
根据公式V=$\frac{m}{ρ}$可得:水的体积为:$\frac{220g}{1g/mL}$=220mL;故答案为:220.
点评 本题综合考查了配制一定质量分数溶液的步骤、所需仪器、托盘天平的使用、稀释原理等,是基础也是常考的知识点之一.

| A. | 质子数不同 | B. | 中子数不同 | ||
| C. | 电子数不同 | D. | 相对原子质量不同 |
(1)酸雨是pH小于5.6的降雨.
(2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2与O2化合生成CaSO4,化学方程式为2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4;
(3)实验可用氢氧化钠溶液吸收二氧化硫,方程式为:SO2+2NaOH═Na2SO3+H2O;若用80g20%的氢氧化钠溶液吸收,理论上可吸收二氧化硫多少?
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液的中盐成分进行如何探究:
【提出猜想】反应后的混合溶液中盐的成份是什么?
【进行猜想】猜想1:只有K2SO3 猜想2:K2SO4; 猜想3:既有K2SO4,也有K2SO3
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | |
| 2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 证明含有K2SO3 |
| 3 | 向B试管中,加入氯化钡溶液,再加入足量的稀盐酸; | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立 |
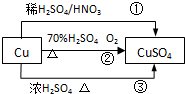 CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)
CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)| A. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| B. | 途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | 1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为1:1 |
| A. | 氧气 | B. | 氮气 | C. | 稀有气体 | D. | 其它气体和杂质 |
| A. | -2 | B. | +2 | C. | +1 | D. | -1 |
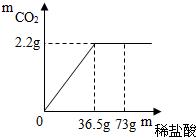 现有7g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应,该反应的化学方程式为:
现有7g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应,该反应的化学方程式为: