题目内容
3.工业上可利用黄铁矿(主要成分是FeS2)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:①FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 ②Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
③2SO2+O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$2SO3 ④SO3+H2O=H2SO4
元素的化合价发生变化的是( )
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
分析 根据化学反应中物质种类的变化以及元素化合价的改变进行分析解答.
解答 解:①FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应前后铁元素和氧元素的化合价发生了改变;
②Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,该反应前后铁元素和碳元素的化合价发生了改变;
③2SO2+O2$→_{催化剂}^{高温}$2SO3,该反应前后硫元素和氧元素的化合价发生了改变;
④SO3+H2O=H2SO4,该反应前后元素的化合价都不改变;
故选A.
点评 本题考查的是化学反应前后元素化合价的改变,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
13.由物质分类知识可知,属于同一类物质的一组是( )
| A. | 红磷、生铁、甲烷 | B. | 熟石灰、石灰乳、石灰水 | ||
| C. | 食醋、加碘食盐、酱油 | D. | 海水、糖水、蒸馏水 |
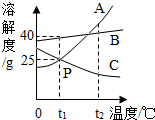 如图是A、B、C三种物质的溶解度曲线(三种物质均不含结晶水):
如图是A、B、C三种物质的溶解度曲线(三种物质均不含结晶水): 已知:AlCl3+3NaOH=Al(OH)3↓+3NaCl.氢氧化钠溶液过量又发生反应:
已知:AlCl3+3NaOH=Al(OH)3↓+3NaCl.氢氧化钠溶液过量又发生反应: A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化或反应关系(“→”表示某一种物质经一步反应可转化为另一种物质.“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).
A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化或反应关系(“→”表示某一种物质经一步反应可转化为另一种物质.“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).