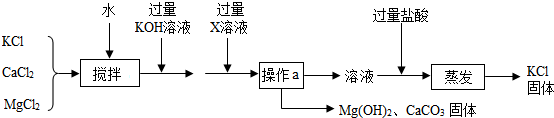
题目内容
2.物质的组成、性质、用途密切相关,请用下列物质的标号填空:A.氧气 B.干冰 C.甲烷 D.钛合金 E.硝酸钾
(1)天然气的主要成分是C;
(2)能供给呼吸的是A;
(3)可用作复合肥的是E;
(4)可用于制造人造骨的是D;
(5)可用于人工降雨的是B.
分析 物质的性质决定物质的用途,根据常见化学物质的性质和用途进行分析解答即可.
解答 解:(1)天然气的主要成分是甲烷;
(2)能供给呼吸的是氧气;
(3)可用作复合肥的是硝酸钾;
(4)可用于制造人造骨的是钛合金;
(5)可用于人工降雨的是干冰,
故答案为:C;A;E;D;B
点评 本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,既可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是Ca(ClO)2在空气中发生反应:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应方程式为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小 (填“增大”或“减小”或“不变”).
(3)在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式Ca(ClO)2+2HCl=CaCl2+2HClO.
(4)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列实验探究.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应方程式为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小 (填“增大”或“减小”或“不变”).
(3)在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式Ca(ClO)2+2HCl=CaCl2+2HClO.
(4)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列实验探究.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
17.配制一定溶质质量分数的氯化钠溶液,下列操作正确的是( )
| A. |  取用药品 | B. |  称量药品 | C. |  读取体积 | D. |  溶解固体 |
7.如图为实验室制取气体的常见装置:

(1)仪器a的名称是长颈漏斗;
(2)以A为发生装置,用高锰酸钾制取氧气,化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,试管口放一团棉花的作用是防止加热时高锰酸钾粉末进入导管;
(3)以B为发生装置制取二氧化碳,加入药品之前要先检查装置的气密性,收集二氧化碳通常选用C(填标号);
(4)温度、浓度、固体的颗粒大小等因素会影响反应速率.为研究实验室制取二氧化碳的适宜条件,进行如表四组实验:
①大理石与盐酸反应的化学方程式是CaCO3+2HCl═CaCl2+H2O+CO2↑;
②实验甲与丙对照(填编号),是为了研究固体反应物颗粒大小对反应速率的影响;
③上述实验中,另一个影响反应速率的因素是盐酸的浓度.

(1)仪器a的名称是长颈漏斗;
(2)以A为发生装置,用高锰酸钾制取氧气,化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,试管口放一团棉花的作用是防止加热时高锰酸钾粉末进入导管;
(3)以B为发生装置制取二氧化碳,加入药品之前要先检查装置的气密性,收集二氧化碳通常选用C(填标号);
(4)温度、浓度、固体的颗粒大小等因素会影响反应速率.为研究实验室制取二氧化碳的适宜条件,进行如表四组实验:
 | 甲 | 乙 | 丙 | 丁 |
| mg大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
| mg验算(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
②实验甲与丙对照(填编号),是为了研究固体反应物颗粒大小对反应速率的影响;
③上述实验中,另一个影响反应速率的因素是盐酸的浓度.
14.有元素化合价升降的反应是氧化还原反应.下列反应不属于氧化还原反应的是( )
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O |
2.对物质进行分类研究,是学习化学的重要方法.下列物质的分类正确的是( )
| A. | 单质:金刚石、水银、钢 | B. | 碱:烧碱、纯碱、熟石灰 | ||
| C. | 氧化物:水、干冰、过氧化钠 | D. | 酸:硫酸、硝酸、碳酸钙 |