题目内容
20.侯德榜是在中国化学工业史上一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,以下是侯德榜先生制碱工业的简要流程:
下表是三种物质在100g水中不同温度的溶解度.
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 45.8 | 50.4 | 55.2 | 60.2 |
| NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
(1)操作Ⅲ中用到的玻璃仪器有过滤.
(2)分析上述溶解度表,欲从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体,可采用的方法是蒸发浓缩、冷却结晶、过滤.
(3)为什么不在饱和食盐水中直接通入足量的二氧化碳气体,而是先通入足量氨气后再通入足量的二氧化碳?先通入足量氨气后形成铵盐水,更有利于二氧化碳气体的吸收.
(4)写出步骤I和步骤Ⅱ两步反应的总化学方程式NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl.
分析 (1)根据过滤可用于分离难溶性固体和可溶性固体的方法进行解答;
(2)根据氯化铵的溶解度随温度的升高而增大,氯化钠的溶解度受温度的影响变化不大进行解答.
(3)根据NH3极易溶于水,而CO2在水中的溶解度不大,据此分析;
(4)根据反应物和生成物分析.
解答 解:(1)过滤可用于分离难溶性固体和可溶性固体的方法,所以Ⅲ的操作名称叫过滤;
(2)氯化铵的溶解度随温度的升高而增大,氯化钠的溶解度受温度的影响变化不大,所以从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体的方法是蒸发浓缩、冷却结晶、过滤.
(3)NH3极易溶于水,而CO2在水中的溶解度不大,故应先向饱和NaC1溶液中通入足量NH3,再通入足量CO2,可析出NaHCO3晶体,
(4)向饱和食盐水中通入足量氨气至饱和,然后通入二氧化碳,析出溶解度较小的碳酸氢钠,化学方程式为:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl.
故答案为:(1)过滤;
(2)蒸发浓缩、冷却结晶、过滤;
(3)先通入足量氨气后形成铵盐水,更有利于二氧化碳气体的吸收;
(4)NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl.
点评 本题是一道有关工业制纯碱知识的综合实验题目,考查学生分析和解决问题的能力,掌握制碱原理是解题的关键,题目难度中等.

练习册系列答案
相关题目
9.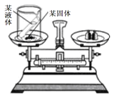 某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律. 则小试管中的液体和烧杯中的固体应分别选用( )
某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律. 则小试管中的液体和烧杯中的固体应分别选用( )
 某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律. 则小试管中的液体和烧杯中的固体应分别选用( )
某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律. 则小试管中的液体和烧杯中的固体应分别选用( )| A. | 水和氯化钠固体 | B. | 氢氧化钙溶液和碳酸钠粉末 | ||
| C. | 稀盐酸和铁粉 | D. | 5%双氧水和二氧化锰粉末 |
15.家用电器中常使用大量的印刷电路板,在制电路板时常用氯化铁溶液作为“腐蚀液”.发生反应的化学方程式如下:2FeCl3+Cu=2FeCl2+CuCl2.现向盛有FeCl3溶液的烧杯中,同时加入铁粉和铜粉,下列有关说法正确的是( )
| A. | 该化学反应属于置换反应 | |
| B. | 该化学反应中FeCl3是还原剂,发生氧化反应 | |
| C. | 反应过程中各元素的化合价都发生变化 | |
| D. | 反应结束后,烧杯中可能铜、铁都没有 |
5.下列除去杂质的方法正确的是( )
| 选项 | 物质 | 所含杂质 | 除杂质的方法 |
| A | 二氧化锰 | 氯化钠 | 加水溶解,过滤,蒸发结晶 |
| B | 氯化钠溶液 | 碳酸钠 | 加入过量稀盐酸,加热蒸发 |
| C | 氯化钙溶液 | 稀盐酸 | 加入过量氢氧化钙,过滤 |
| D | 氢氧化钠溶液 | 碳酸钠 | 加入适量的石灰水 |
| A. | A | B. | B | C. | C | D. | D |
12.埃博拉病毒是当今世界上最凶险的病毒之一,其致死率可高达90%,国外最近研制出抗击埃博拉病毒的药物Favipiravir,其化学式为C5H4N3O2F.下列说法错误的是( )
| A. | 该药物由5种元素组成 | |
| B. | 该药物的分子中碳氧原子个数比为5:2 | |
| C. | 该药物由15个原子构成 | |
| D. | 该药物中氟元素的质量分数最小 |
10.鉴别氢氧化钠、氢氧化钙、稀盐酸三种溶液,可选用的试剂是( )
| A. | 紫色石蕊试液 | B. | 无色酚酞试液 | C. | 氯化铁溶液 | D. | 碳酸钠溶液 |
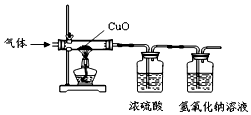 某气体由氢气、一氧化碳、水蒸气中的一种或几种组成.把该气体依次通过下列装置后,测得装有浓硫酸的装置质量增加,装有氢氧化钠溶液的装置质量不变.
某气体由氢气、一氧化碳、水蒸气中的一种或几种组成.把该气体依次通过下列装置后,测得装有浓硫酸的装置质量增加,装有氢氧化钠溶液的装置质量不变. 如图是一张化学扑克,它的玩法规则是:上家出牌,下家只能出能与上家所出牌中物质发生反应的牌,依此规则出牌.在某局牌中,上家出了一张如图的“硝酸”牌,下面是A、B、C、D四位玩家手中都剩下的一张牌,则你认为最后出不掉的应该是( )
如图是一张化学扑克,它的玩法规则是:上家出牌,下家只能出能与上家所出牌中物质发生反应的牌,依此规则出牌.在某局牌中,上家出了一张如图的“硝酸”牌,下面是A、B、C、D四位玩家手中都剩下的一张牌,则你认为最后出不掉的应该是( )


