题目内容
13.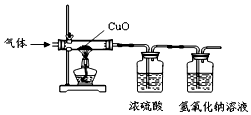 某气体由氢气、一氧化碳、水蒸气中的一种或几种组成.把该气体依次通过下列装置后,测得装有浓硫酸的装置质量增加,装有氢氧化钠溶液的装置质量不变.
某气体由氢气、一氧化碳、水蒸气中的一种或几种组成.把该气体依次通过下列装置后,测得装有浓硫酸的装置质量增加,装有氢氧化钠溶液的装置质量不变.(1)装置中的浓硫酸的作用是利用了浓硫酸的吸水性.
(2)该气体中一定不存在一氧化碳.
(3)若实验中观察到黑色粉末逐渐变红色现象,就可证明原气体中存在氢气.
分析 (1)根据装置中的浓硫酸的作用是吸收水蒸气,进行分析解答.
(2)装有浓硫酸的装置质量增加,说明有水蒸气生成;装有氢氧化钠溶液的装置质量不变,说明没有二氧化碳生成,进行分析解答.
(3)根据氢气能与氧化铜反应生成铜和二氧化碳,进行分析解答.
解答 解:(1)装置中的浓硫酸的作用是吸收水蒸气,是利用了浓硫酸的吸水性.
(2)装有浓硫酸的装置质量增加,说明有水蒸气生成;装有氢氧化钠溶液的装置质量不变,说明没有二氧化碳生成,则该气体中一定不存在一氧化碳,因为一氧化碳能与氧化铜在加热条件下反应生成二氧化碳.
(3)由于原气体中可能有水蒸气存在,氢气能与氧化铜反应生成铜和二氧化碳,实验中观察到黑色粉末逐渐变红色,就可证明原气体中存在氢气.
故答案为:(1)吸水;(2)一氧化碳;(3)黑色粉末逐渐变红色.
点评 本题难度不大,掌握常见气体的检验方法、浓硫酸的吸水性等是正确解答本题的关键.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
18.相同质量的H2、CH4和CO完全燃烧需要氧气的质量(CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,2CO+O2$\stackrel{点燃}{→}$2CO2)( )
| A. | CO最多,H2最少 | B. | H2最多,CH4最少 | C. | H2最多,CO最少 | D. | CH4最多,CO最少 |
5.走进华能长兴电厂,庞大的建筑物和高高的烟囱映入眼帘,这些就是低低温省煤器、低低温电除尘和高效除尘脱硫吸收塔,华能长兴电厂采用烟气协同治理的关键技术,通过这些设备,大大降低了烟尘、二氧化硫和氮氧化物的排放值.下列环保效果不是这些设备所能起的是( )
| A. | 减少空气中可吸入颗粒物的含量 | B. | 缓和温室效应 | ||
| C. | 减少酸雨的发生 | D. | 防止臭氧层空洞进一步扩大 |
2.规范的操作是确保实验成功的关键,下列所示的操作正确的是( )
| A. |  测定液体pH值 | B. |  稀释浓硫酸 | C. |  镁与稀盐酸反应 | D. |  干燥氧气 |
20.侯德榜是在中国化学工业史上一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,以下是侯德榜先生制碱工业的简要流程:

下表是三种物质在100g水中不同温度的溶解度.
试回答下列问题:
(1)操作Ⅲ中用到的玻璃仪器有过滤.
(2)分析上述溶解度表,欲从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体,可采用的方法是蒸发浓缩、冷却结晶、过滤.
(3)为什么不在饱和食盐水中直接通入足量的二氧化碳气体,而是先通入足量氨气后再通入足量的二氧化碳?先通入足量氨气后形成铵盐水,更有利于二氧化碳气体的吸收.
(4)写出步骤I和步骤Ⅱ两步反应的总化学方程式NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl.

下表是三种物质在100g水中不同温度的溶解度.
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 45.8 | 50.4 | 55.2 | 60.2 |
| NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
(1)操作Ⅲ中用到的玻璃仪器有过滤.
(2)分析上述溶解度表,欲从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体,可采用的方法是蒸发浓缩、冷却结晶、过滤.
(3)为什么不在饱和食盐水中直接通入足量的二氧化碳气体,而是先通入足量氨气后再通入足量的二氧化碳?先通入足量氨气后形成铵盐水,更有利于二氧化碳气体的吸收.
(4)写出步骤I和步骤Ⅱ两步反应的总化学方程式NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl.



