题目内容
2.下列图示操作正确的是( )| A. |  液体读数 | B. |  滴加液体 | C. |  加热固体 加热固体 | D. |  倾倒液体 |
分析 A、根据量筒使用注意事项分析
B、根据胶头滴管使用注意事项分析
C、根据给固体加热注意事项分析
D、根据倾倒液体注意事项分析
解答 解:A、量筒读数时,视线应与凹液面的最低处保持水平,A图中没有与最低处相平,故A错误.
B、胶头滴客滴加液体时,应竖直于试管口的正上方,不能触及试管内部,B图中试管伸入试管内,B错误;
C、给固体加热时,试管口略低于试管底,用酒精灯外焰加热,C正确;
D、倾倒液体时,取下瓶塞倒放在桌面上,D图中瓶塞正放,D错误;
故选C
点评 根据装置特点可以判断装置图的正误,根据操作要求可以判断操作是否符合实验室的规定,难度不大.

练习册系列答案
相关题目
6.将t℃时的某饱和溶液蒸发一定量水后再恢复到t℃有晶体析出.下列说法不正确的是( )
| A. | 溶质质量减小 | B. | 溶液仍为t℃时的饱和溶液 | ||
| C. | 溶质在t℃时的溶解度不变 | D. | 溶液质量不变 |
3.研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
【假设】H2O2生成O2的快慢与催化剂种类有关.
实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】图丁是他们进行实验的装置图,气体发生装置中A仪器的名称是锥形瓶,此实验中B处宜采用的气体收集方法是排水法.
【实验记录】
【结论】该探究过程得出的结论是相同条件下H2O2生成O2的快慢与催化剂的种类有关.
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快.若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否改变.
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
【假设】H2O2生成O2的快慢与催化剂种类有关.
实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】图丁是他们进行实验的装置图,气体发生装置中A仪器的名称是锥形瓶,此实验中B处宜采用的气体收集方法是排水法.
【实验记录】
| 实验编号 | 1 | 2 |
| 反应物 | 5% H2O2 | 5%H2O2 |
| 催化剂 | 1g水泥块 | 1g二氧化锰 |
| 时间 | 165s | 46s |
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快.若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否改变.
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
| 实验步骤 | 现 象 | 结 论 |
| 取一支试管加入3mL5%的过氧化氢溶液,然后加入少量二氧化锰. | 缓慢有少量气泡冒出 | 浓度越大,过氧化氢分解的速率越快 |
| 另取一支试管加入3mL15%的过氧化氢溶液,然后加入少量二氧化锰. | 迅速有大量气泡冒出 |
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
| 实验步骤 | 现 象 | 结 论 |
| 取一支试管加入5mL 15%的过氧化氢溶液.然后把试管放入盛有冷水的烧杯中; 取一支试管加入5mL 15%的过氧化氢溶液.然后把试管放入盛有热水的烧杯中 | 缓慢有少量气泡冒出; 迅速有大量气泡冒出 | 温度越高,过氧化氢分解的速率越大 |
14.下列属于化学性质的是( )
| A. | 溶解性 | B. | 挥发性 | C. | 金属活动性 | D. | 导电性 |
11.工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3 晶体的原因是KClO3在常温下溶解度较小.
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
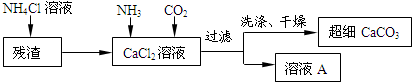
(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为常见的两种化合物,其中碳酸钠最为重要,在工业上有广泛的应用.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为常见的两种化合物,其中碳酸钠最为重要,在工业上有广泛的应用.

