题目内容
10.煅烧石灰石可制得生石灰,如果要制取2.8t氧化钙,需要碳酸钙的质量是多少?分析 石灰石的主要成分是碳酸钙,碳酸钙在高温条件下分解生成氧化钙和二氧化碳,根据氧化钙的质量可以计算碳酸钙的质量.
解答 解:设需要碳酸钙的质量为x,
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
100 56
x 2.8t
$\frac{100}{x}$=$\frac{56}{2.8t}$,
x=5t,
答:需要5t碳酸钙.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
20.某课外小组,用含有较多杂质的石灰石,通过以下三途径制取牙膏中的摩擦剂-轻质碳酸钙,对三种途径的说法不正确的是( )


| A. | 与途径Ⅰ,Ⅱ相比,途径Ⅲ节约能源 | B. | 与途径Ⅱ,Ⅲ相比,途径Ⅰ节省原料 | ||
| C. | 与途径Ⅰ,Ⅲ相比,途径Ⅱ产品纯度高 | D. | 三种途径都是通过沉淀得到产品 |
1.下列物质属于纯净物的是( )
| A. | 波尔多液 | B. | 浓硫酸 | C. | 液氧 | D. | 加碘盐 |
5. 由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“
由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“ ”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )
”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )
 由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“
由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“ ”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )
”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )| A. | 物质E一定是水 | B. | 物质C属于有机化合物 | ||
| C. | 物质B、F都具有还原性 | D. | 物质D具有可燃性 |
15.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说话不正确的是( )


| A. | 甲中混有少量乙时,可用降温结晶法提纯甲 | |
| B. | t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃时,甲析出的晶体最多,丙无晶体析出 | |
| C. | t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃时,溶液中溶质的质量分数为乙>甲>丙 | |
| D. | t2℃时,100g甲物质溶于100g水中,所得溶液的质量为200g |
2.饮食健康是人民群众普遍的生活需求,下列说法正确的是( )
| A. | 用地沟油煎炸食品 | |
| B. | 用霉变大米制米粉 | |
| C. | 酱油中添加铁元素有助于预防缺铁性贫血 | |
| D. | 奶茶中添加塑化剂使其口感更加香醇 |
19.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如下表所示.下列说法中不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质质量/g | 8 | 32 | 5 | 4 |
| 反应后物质质量/g | 16 | 4 | x | 24 |
| A. | 生成甲、丁两种物质的质量比为1:4 | |
| B. | 丙一定是该反应的催化剂 | |
| C. | 该反应为分解反应 | |
| D. | 乙、丁两种物质间反应的质量比为7:5 |

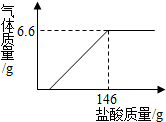 现将19.9g含氢氧化钠的碳酸钠固体中加入100g水充分溶解,向该溶液中逐滴加入一定溶质质量分数的盐酸,生成气体的质量与加入盐酸的质量关系如图所示.请计算
现将19.9g含氢氧化钠的碳酸钠固体中加入100g水充分溶解,向该溶液中逐滴加入一定溶质质量分数的盐酸,生成气体的质量与加入盐酸的质量关系如图所示.请计算