题目内容
6.某化学兴趣小组在实验室利用下列实验装罝及药品,完成以下实验任务:①制备纯净干燥的二氧化碳气体②用一氧化碳气体测定某不纯氧化铁样品的纯度.试根据题目耍求,回答下列问题:(设过程中所有发生的反应都恰好完全进行,实验中可能挥发少量的HCl气体).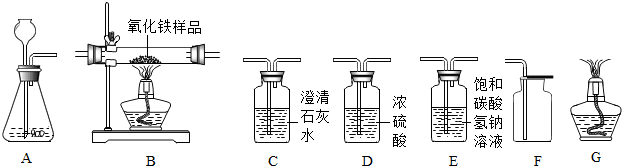
(1)若要用石灰石和稀盐酸为原料制备并收集纯净干燥的二氧化碳,小组设计的仪器的连接顺序为A→D→E→F.
①仪器A中发生反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
②上述仪器连接的顺序是否合理?请简述理由:不合理,气体再通过碳酸氢钠溶液时仍然会带走一定量的水蒸气.
(2)欲用含二氧化碳的一氧化碳气体,测定某不纯氧化铁样品的纯度(杂质不反应),并验证反应中气体生成物的性质,某同学所选仪器的连接顺序为:混合体→B→C→G.
①装置C中出现的现象是:石灰水变浑浊.
②若反应前装置B中样品质S为ag,反应后装罝B中固体质量为bg,则样品中氧化铁的质量分数为$\frac{3(a-b)}{10a}$(用含a和b的代数式表示).
③若用反应后装置C中增加的质量来计算样品中氧化铁的质量分数,结果将偏大(选填“偏大”、“偏小”、“不受影响”之一),请说明理由原混合气体中的CO2也进入C中,使质量偏大.
分析 (1)实验室中常用石灰石和稀盐酸制取二氧化碳,产生氯化钙、水和二氧化碳,写出化学反应方程式;
要收集一瓶干燥、纯净的二氧化碳气体,就要把杂质氯化氢气体和水蒸气除去,氯化氢气体用碳酸氢钠溶液除去,水蒸气用浓硫酸除去;
(2)根据二氧化碳与氢氧化钙的反应分析实验的现象;
根据B装置减少的质量就是氧化铁中氧元素的质量可求出氧化铁的质量,再求出氧化铁样品中氧化铁的纯度.
实验前没有除去一氧化碳中混有的二氧化碳,导致装置C增重的质量偏大,导致计算出来的氧化铁质量偏大.
解答 解:(1)①实验室中常用石灰石和稀盐酸制取二氧化碳,产生氯化钙、水和二氧化碳,化学反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②要收集一瓶干燥、纯净的二氧化碳气体,就要把杂质氯化氢气体和水蒸气除去,要先除氯化氢气体,氯化氢气体与碳酸氢钠溶液反应生成氯化钠、水和二氧化碳,因此可以除去氯化氢气体;再用浓硫酸进行干燥,最后收集;故填:不合理,气体再通过碳酸氢钠溶液时仍然会带走一定量的水蒸气;
(2)①二氧化碳能与氢氧化钙反应生成了碳酸钙沉淀和水,所以,仪器C中看到的现象是澄清的石灰水变浑浊.故填:石灰水变浑浊;
②装置B减少的质量即为氧化铁中氧元素的质量,为(a-b)g;
因此Fe2O3的质量为(a-b)g×$\frac{16×3}{56×2+16×3}×100%$=$\frac{3(a-b)g}{10}$
则样品中氧化铁的质量分数为$\frac{\frac{3(a-b)g}{10}}{ag}×100%$=$\frac{3(a-b)}{10a}$;故填:$\frac{3(a-b)}{10a}$;
10(a-b)/3a
③实验前没有除去一氧化碳中混有的二氧化碳,导致装置C增重的质量偏大,导致计算出来的氧化铁质量偏大;故填:偏大;原混合气体中的CO2也进入C中,使质量偏大.
点评 明确装置的选取方法,了解制取二氧化碳的反应原理,一氧化碳的性质及其应用;考查了学生对知识的掌握和应用.应全面地掌握二氧化碳的制取、一氧化碳还原氧化铁的知识才能解答好本题.

| A. | 自来水是纯净物 | |
| B. | 肥皂水可以区分软水和硬水 | |
| C. | 工业废水不能直接排放 | |
| D. | 过量使用农药、化肥会造成水体污染 |
①海水淡化 ②海水提镁 ③海水晒盐 ④海水制碱.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①③ |
①滤液中只含有FeSO4 ②滤液中含有FeSO4和ZnSO4 ③滤渣中一定含有Zn、Fe、Cu ④滤渣中只含有Fe和Cu⑤滤渣的质量一定大于原铁粉的质量 ⑥滤渣的质量一定小于原铁粉的质量.
| A. | 只有①③ | B. | 只有②④ | C. | 只有②⑤ | D. | 只有③⑥ |
| 项目 | 能量 | 蛋白质 | 脂肪 | 糖类 | 钠 |
| 每100g | 329kJ | 2.6g | 3.1g | 10.0g | 60mg |
(1)酸奶中的蛋白质在消化道内会逐渐被分解成可被人体吸收的多种氨基酸.
(2)脂肪在人体内分解、氧化释放出能量的过程,是将化学能转化为热能.
(3)蔗糖(C12H22O11)是酸奶中的一种糖类物质,蔗糖的组成中碳、氢元素的质量比为(最简整数比)72:11.
(4)在选择制作酸奶包装盒的材料时,从化学性质的角度分析该材料应具备耐酸的特点(填写一条即可)
| A. |  检查装置气密性 | B. |  滴加液体 | C. |  溶解固体 | D. |  熄灭酒精灯 |

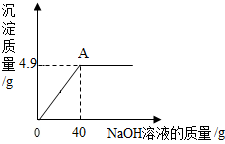 向160g硫酸铜溶液中,逐滴加入40g NaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题:
向160g硫酸铜溶液中,逐滴加入40g NaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题: