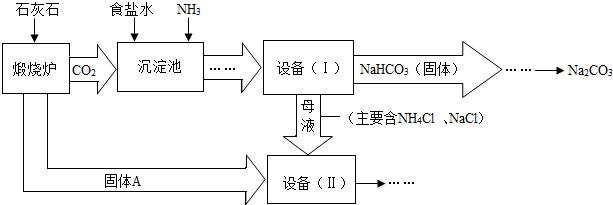
题目内容
16.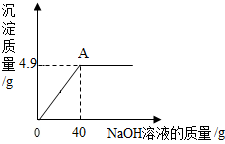 向160g硫酸铜溶液中,逐滴加入40g NaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题:
向160g硫酸铜溶液中,逐滴加入40g NaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题:(1)恰好完全反应后,溶液的质量为195.1gg.
(2)将反应结束后的混合物过滤,滤液中溶质是Na2SO4(填化学式).
(3)求原硫酸铜溶液中溶质的质量分数(写出计算过程)
分析 (1)根据质量守恒定律计算恰好完全反应后,溶液的质量;
(2)根据图示和题意可知,A点为硫酸铜溶液和NaOH溶液恰好完全反应,故滤液中所含溶质为硫酸钠;
(3)根据化学方程式和题中所给数据计算参加反应的硫酸铜的质量,然后计算硫酸铜的质量分数.
解答 解:(1)恰好完全反应后,溶液的质量为:160g+40g-4.9g=195.1g;
(2)A点为硫酸铜溶液和NaOH溶液恰好完全反应,故滤液中所含溶质为硫酸钠,化学式为:Na2SO4;
(3)设参加反应的硫酸铜的质量为x
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
160 98
x 4.9g
$\frac{160}{98}$=$\frac{x}{4.9g}$
x=8g
所以原硫酸铜溶液中溶质的质量分数为:$\frac{8g}{160g}$×100%=5%.
故答案为:(1)195.1g;
(2)Na2SO4;
(3)原硫酸铜溶液中溶质的质量分数为5%.
点评 本题是根据化学方程式与溶液结合一道综合计算题,会从题目中获取信息是正确解决本题的关键.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
4.下列关于空气成分的说法错误的是( )
| A. | 空气的成分按体积计算,氧气约占21% | |
| B. | 干冰可作制冷剂 | |
| C. | 食品包装中充入氮气防腐 | |
| D. | 将带火星的木条伸入氧气集气瓶中,木条复燃,证明氧气已收集满 |
11.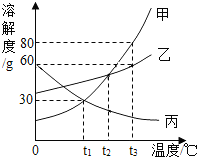 如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )
如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )
 如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )
如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )| A. | 甲中混有少量杂质乙,可采用降温结晶的方法进行提纯 | |
| B. | t3℃时,将甲、丙的饱和溶液降温,甲溶液溶质的质量分数减小,丙不变 | |
| C. | t2℃时,甲、丙溶液中溶质的质量分数甲>丙 | |
| D. | t1℃时,60g水中溶解18g甲可得到其饱和溶液 |
12.如图各组转化中,一定条件下均能一步实现的组合是( )


| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
10.下列关于物质性质及用途的描述中,正确的是( )
| A. | 氧气具有氧化性,可作为燃料 | |
| B. | 碳酸氢钠能与酸反应,可用来治疗胃酸过多 | |
| C. | 洗洁精能洗去碗筷上的油污,是因为洗洁精能溶解油污 | |
| D. | 氢氧化钠固体易吸水,可用来干燥CO2气体 |


 投入几小块烘烤过的木炭.红棕色会消失的原因是木炭有吸附性,吸附NO2,红棕色消失;
投入几小块烘烤过的木炭.红棕色会消失的原因是木炭有吸附性,吸附NO2,红棕色消失; 装置中玻璃管的作用是引燃红磷、使瓶内气体进入气球中;
装置中玻璃管的作用是引燃红磷、使瓶内气体进入气球中; 根据质量守恒定律解释高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小的原因高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,反应后氧气逸出,故剩余固体的质量比原反应物的质量小.
根据质量守恒定律解释高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小的原因高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,反应后氧气逸出,故剩余固体的质量比原反应物的质量小.