题目内容
1.实验室有一瓶存放时间长的氢氧化钠,其中的一部分已经转化成了碳酸钠.现要用该药品配制10%的氢氧化钠溶液.取50.6g该药品,溶于200mL水中,然后慢慢地滴入17.1%的氢氧化钡溶液,当用去100g氢氧化钡溶液时,碳酸钠恰好完全反应[Na2CO3+Ba(OH)2=BaCO3↓+2NaOH].求:(1)50.6g该药品中碳酸钠的质量.
(2)滤出沉淀后溶液中溶质质量和溶液质量.
(3)向所得溶液中再加入多少毫升水中才能配成10%的氢氧化钠溶液?
分析 (1)根据氢氧化钡的质量,利用碳酸钠与氢氧化钡的反应求出碳酸钠的质量即可;
(2)溶液中氢氧化钠的质量等于原固体中氢氧化钠的质量与反应生成的氢氧化钠的质量之和,根据氢氧化钡质量求出生成的氢氧化钠的质量,溶液的质量等于混合前的物质的总质量与生成沉淀的质量之差,据此完成解答即可;
(3)求出反应溶液中氢氧化钠的质量分数,然后根据稀释前后溶液中溶质的质量不变进行解答.
解答 解:(1)反应的氢氧化钡的质量=100g×17.1%=17.1g
设50.6克该药品中碳酸钠的质量为x,生成NaOH的质量为y,生成BaCO3的质量为z.
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH
106 171 197 80
x 17.1g z y
则:$\frac{106}{x}=\frac{171}{17.1g}=\frac{197}{z}=\frac{80}{y}$
解得:x=10.6g y=8g,z=19.7g
(2)氢氧化钠溶液中溶质的质量=50.6g-10.6g+8g=48g
氢氧化钠溶液的质量=50.6g+200g+100g-19.7g=330.9g
(3)需加入水的体积=48g÷10%-330.9g=149.1g
答:(1)50.6g 该药品中碳酸钠的质量为10.6g.
(2)滤出沉淀后溶液中溶质质量是48g,溶液质量的质量是330.9g.
(3)向所得溶液中再加入149.1g水才能配成10%的氢氧化钠溶液.
点评 此题是一道化学方程式的计算题,解题的关键是能够对相关的反应的掌握,理清反应的思路结合化学方程式的计算是解题的关键.

练习册系列答案
相关题目
11.纪录片《穹顶之下》引起了社会对空气质量的热议.以下不属于空气污染物的是( )
| A. | 水蒸气 | B. | 二氧化硫 | C. | 可吸入颗粒物 | D. | 一氧化碳 |
12.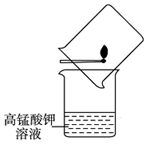 教材上有这么一个实验:将含硫火柴在盛有高锰酸钾溶液的烧杯上方点燃,并用另一烧杯罩住火柴,如图所示.下列关于该实验的说法中不正确的是( )
教材上有这么一个实验:将含硫火柴在盛有高锰酸钾溶液的烧杯上方点燃,并用另一烧杯罩住火柴,如图所示.下列关于该实验的说法中不正确的是( )
 教材上有这么一个实验:将含硫火柴在盛有高锰酸钾溶液的烧杯上方点燃,并用另一烧杯罩住火柴,如图所示.下列关于该实验的说法中不正确的是( )
教材上有这么一个实验:将含硫火柴在盛有高锰酸钾溶液的烧杯上方点燃,并用另一烧杯罩住火柴,如图所示.下列关于该实验的说法中不正确的是( )| A. | 硫燃烧时发生了化学变化 | |
| B. | 高锰酸钾溶液褪色,说明发生了化学变化 | |
| C. | 生成的二氧化硫是主要大气污染物之一 | |
| D. | 应积极提倡使用含硫火柴 |
6.有机锗具有抗肿瘤活性,锗元素的部分信息如图,则下列说法错误的是( )


| A. | 在元素周期表中锗元素与硫元素位于同一族 | |
| B. | x=2 | |
| C. | 锗原子的核外电子数为32 | |
| D. | 锗原子夺的中子数为41 |



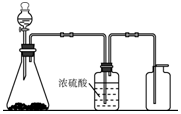 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是B(填正确选项的标号).
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是B(填正确选项的标号).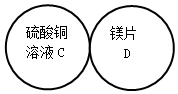 用四个圆表示A(铁片)、B(稀硫酸)、C(硫酸铜溶液)、D(镁片)四种物质,用两圆相切表示两种物质可以发生反应,如图所示.请回答下列问题:(提示:物质间均恰好完全反应,其中稀硫酸与硫酸铜溶液不反应)
用四个圆表示A(铁片)、B(稀硫酸)、C(硫酸铜溶液)、D(镁片)四种物质,用两圆相切表示两种物质可以发生反应,如图所示.请回答下列问题:(提示:物质间均恰好完全反应,其中稀硫酸与硫酸铜溶液不反应)