题目内容
3.向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸有白色沉淀产生.下列说法中,正确的是( )| A. | 所得滤渣中一定含有铜和锌 | |
| B. | 所得滤渣中一定含有银和铜 | |
| C. | 所得滤渣中一定含有银、铜和锌 | |
| D. | 所得滤液中一定含有Ag+、Zn2+、Cu2+ |
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,结合实验现象进行分析滤渣和滤液的成分.
解答 解:在金属活动性顺序中,锌>氢>铜>银,锌能与硝酸银反应生成银和硝酸锌,可以和硝酸铜反应生成铜和硝酸锌;所以放入锌后锌要先置换出硝酸银中银,再去置换硝酸同种的铜,所以如果向所得滤液中加稀盐酸有白色沉淀生成,说明溶液中还存在银离子其白色沉淀是氯化银,因此硝酸铜一定还没有反应,所以滤渣只能是银,不能含有铜和锌;滤液中的金属阳离子会有锌离子和没有反应的铜离子及剩余的银离子.观察选项,故选项为:D.
点评 此题考查了金属活动顺序表中锌、铜、银的金属活动性强弱,及其金属活动性顺序表的应用,锻炼了学生分析问题解决问题的能力.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
15. 如图是A、B、C三种物质的溶解度曲线,下列分析错误的是( )
如图是A、B、C三种物质的溶解度曲线,下列分析错误的是( )
 如图是A、B、C三种物质的溶解度曲线,下列分析错误的是( )
如图是A、B、C三种物质的溶解度曲线,下列分析错误的是( )| A. | 50℃时,A物质的溶解度最大 | |
| B. | 50℃时,把90gA物质放入100g水中能得到190g溶液 | |
| C. | 20℃时,B物质饱和溶液的溶质质量分数最大 | |
| D. | 升温可使C物质的不饱和溶液变成饱和溶液 |
12.除去下列物质中的杂质所选用的试剂及操作方法正确的一组是( )
| 选项 | 物 质 | 所含杂质 | 除 去 杂 质 的 方 法 |
| A | Cu | CuO | 加入过量的稀硫酸、过滤、洗涤、干燥 |
| B | N2 | O2 | 放入足量的红磷后点燃 |
| C | NaCl溶液 | NaOH | 加入适量稀盐酸,蒸发、结晶 |
| D | FeSO4 | CuSO4 | 先加水溶解,再加足量金属铁,过滤,洗涤,干燥 |
| A. | A | B. | B | C. | C | D. | D |
2.工业生产的纯碱中常常含有一定量的氯化钠.为了测定某批次纯碱中碳酸钠的质量分数,小明同学称取12g纯碱样品放入烧杯中,用相同溶质质量分数的稀盐酸50g,分5次加入,每次充分反应后,称重、计算生成二氧化碳的质量,记录如下:
请回答:
(1)在第四次实验中,碳酸钠完全反应.
(2)求所取样品中碳酸钠的质量分数(计算结果保留一位小数).
| 实验次数 | 稀盐酸用量(g) | 生成二氧化碳的质量(g) |
| 1 | 10 | 1.1 |
| 2 | 10 | 2.2 |
| 3 | 10 | 3.3 |
| 4 | 10 | 4.4 |
| 5 | 10 | 4.4 |
(1)在第四次实验中,碳酸钠完全反应.
(2)求所取样品中碳酸钠的质量分数(计算结果保留一位小数).

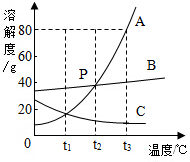 如图是A、B、C三种物质的溶解度曲线,回答下列问题:
如图是A、B、C三种物质的溶解度曲线,回答下列问题:
 如图是学生经常使用的交通工具.自行车,请完成下列各题:
如图是学生经常使用的交通工具.自行车,请完成下列各题: