题目内容
1.Na2SO4是制造纸张、药品、染料稀释剂等的重要原料.某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如图所示.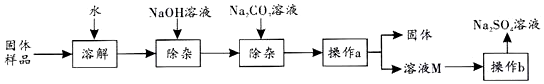
(1)加入NaOH溶液可除去的阳离子是Mg2+(填离子符号),其反应的化学方程式为MgCl2+2NaOH═Mg(OH)2↓+2NaCl.若添加的NaOH溶液和Na2CO3溶液过量,可加入适量稀硫酸 (填名称)除去.
(2)操作a的名称是过滤,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、漏斗.
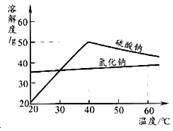
(3)溶液M中的溶质是Na2SO4和杂质NaCl,观察溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤.降温结晶的最佳温度范围是B,
A.40℃以下 B.30℃以下 C.40℃以上
这是因为Na2SO4的溶解度比氯化钠小,且硫酸钠的溶解度受温度影响比氯化钠大
分析 (1)氢氧化钠能和氯化镁反应生成氢氧化镁沉淀和氯化钠;
氢氧化钠能和稀硫酸反应生成硫酸钠和水,碳酸钠能和稀硫酸反应生成硫酸钠、水和二氧化碳;
(2)操作a的名称是过滤,通过过滤能够把液体和固体分离;
过滤操作中需要用到的玻璃仪器有烧杯、玻璃棒和漏斗;
(3)根据物质的溶解度曲线可以判断相关方面的问题.
解答 解:(1)加入NaOH溶液可除去的阳离子是 Mg2+,这是因为氢氧化钠能和氯化镁反应生成氢氧化镁沉淀和氯化钠,其反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
若添加的NaOH溶液和Na2CO3溶液过量,可加入适量的稀硫酸除去,这是因为氢氧化钠能和稀硫酸反应生成硫酸钠和水,碳酸钠能和稀硫酸反应生成硫酸钠、水和二氧化碳.
故填:Mg2+;MgCl2+2NaOH═Mg(OH)2↓+2NaCl;稀硫酸.
(2)操作a的名称是过滤,该操作中需要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
故填:过滤;漏斗.
(3)降温结晶的最佳温度范围是30℃以下,这是因为30℃以下时,Na2SO4的溶解度比氯化钠小,且硫酸钠的溶解度受温度影响比氯化钠大.
故填:B;比氯化钠小,且硫酸钠的溶解度受温度影响比氯化钠大.
点评 本题综合性较强,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质),掌握盐的化学性质、化学方程式的书写、过滤操作及降温结晶等是正确解答本题的关键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
2.下列厨房调味品中含有酸类物质的是( )
| A. | 加碘食盐 | B. | 铁强化酱油 | C. | 食用醋 | D. | 花生油 |
3.下列各组物质在同一溶液中可以大量共存的是( )
| A. | NaOH、FeCl3、K2SO4 | B. | NaCl、HNO3、AgNO3 | ||
| C. | NaCl、K2CO3、Ca(OH)2 | D. | KNO3、NaCl、Ba(OH)2 |
16.有关CuSO4制备途径及性质如图所示.

已知:
(1)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.下列说法正确的是( )

已知:
(1)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.下列说法正确的是( )
| A. | 途径②比途径①更好地体现绿色化学思想 | |
| B. | 途径①中80g铜与200g98%浓硫酸反应可得到160g硫酸铜 | |
| C. | 反应③分解所得混合气体X的成分是SO2和SO3 | |
| D. | 若步骤4中所得沉淀为Cu(OH)2和CuSO4•3 Cu(OH)2,则沉淀中铜元素含量较CuSO4中铜元素含量大 |
6.下列物质与其对应的用途不相符的是( )
| A. | 干冰用于人工降雨 | B. | 氮气用作保护气 | ||
| C. | 氢氧化钠用于治疗胃酸过多 | D. | 熟石灰用于改良酸性土壤 |
10.下列一些事实或对其解释均正确的是( )
| A. | 白磷应保存在水中,是因为它易潮解 | |
| B. | 把铅加入锡中制成合金焊锡,主要目的是降低熔点 | |
| C. | 铵态氮肥应与碱性物质混合保存,是因为能增强肥效 | |
| D. | 用洗涤剂除油污,是因为洗涤剂能将油污溶解形成溶液 |
11.下列物质中,属于磷肥的是( )
| A. | K2SO4 | B. | CO(NO2)2 | C. | KNO3 | D. | Ca(H2PO4)2 |


 A-G表示初中化学常见的物质,其中A可用于玻璃、造纸、纺织、洗涤剂的生产,C是大理石的主要成分,各物质间相互转化关系如图所示,请回答下列问题:
A-G表示初中化学常见的物质,其中A可用于玻璃、造纸、纺织、洗涤剂的生产,C是大理石的主要成分,各物质间相互转化关系如图所示,请回答下列问题: