题目内容
7.若采用手持技术(如图1)做“盐酸中和氢氧化钠溶液”的实验.则不需要加入酚酞作为指示剂就很容易判断反应的终点和溶液的酸碱性.图2是实验时采集的溶液pH和溶液温度随所加入溶液体积的变化曲线,请你根据图中曲线判断:图中的横坐标是NaOH溶液体积,当该溶液体积是18mL时,盐酸中和氢氧化钠溶液恰好反应,此时溶液的pH为7,温度为16.
分析 根据溶液pH的变化情况以及坐标图的信息结合酸碱中和的原理来分析.
解答 解:由坐标图象可知,溶液的pH由<7,到=7,直到>7,所以是向酸中加碱,即横坐标表示氢氧化钠溶液的量;当pH=7时,二者恰好完全中和,此时滴加氢氧化钠溶液约18mL,中和反应放热,此时温度接近16℃.
故答案为:NaOH,18,7,16.
点评 本题考查了酸碱中和反应的相关知识,完成此题,可以依据物质的性质进行.

练习册系列答案
相关题目
19.下列知识归纳完全正确的是( )
| A、能量变化 | B、环境保护 |
| ①电解水是将电能转化为化学能 ②化学反应中只有燃烧放热 | ①合理施用农药和化肥 ②不得随意乱扔塑料垃圾 |
| C、数字含义 | D、资源节约 |
| ①Fe2+一个亚铁离子带2个单位正电荷 ②SO3 三氧化硫中含有3个原子 | ①废旧金属回收利用 ②pH试纸用水润湿后然后进行测定其酸碱度 |
| A. | A | B. | B | C. | C | D. | D |
17.下列实验进行中的现象或实验原理正确的是( )
| A. | 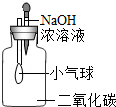 小气球变瘪 | B. |  U型管内液面左高右低 | ||
| C. | 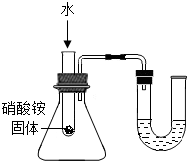 U型管内液面左高右低 | D. | 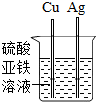 验证铁、铜和银金属活动性强弱 |
 A~E为初中科学中常见的物质,其中A能使带火星的木条复燃,E的浓溶液能使小木棒变黑.它们的反应转化关系如图所示(图中部分生成物未标出).
A~E为初中科学中常见的物质,其中A能使带火星的木条复燃,E的浓溶液能使小木棒变黑.它们的反应转化关系如图所示(图中部分生成物未标出).



