题目内容
16.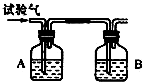 为了检验三种可燃性气体:C2H6(乙烷)、H2和CO(简称试验气),分别将它们在氧气中充分燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶(假设每瓶反应吸收完全),回答下列问题:
为了检验三种可燃性气体:C2H6(乙烷)、H2和CO(简称试验气),分别将它们在氧气中充分燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶(假设每瓶反应吸收完全),回答下列问题:(1)装置A中的液体是浓硫酸;装置B中的液体是氢氧化钠溶液或石灰水.
(2)若装置A的质量不变,B的质量增加,则试验气是CO.
(3)若装置A、B的质量都增加,则试验气是C2H6;此实验气在氧气中充分燃烧的化学方程式是2C2H6+7O2$\frac{\underline{\;点燃\;}}{\;}$4C02+6H2O.若B的质量增加m克,则A的质量增加$\frac{27m}{44}$g克.
分析 (1)要确定C2H6、H2和CO三种可燃性气体,根据C2H6、H2和CO燃烧的产物是水和二氧化碳确定洗气瓶中的物质;
(2)只有水生成的才使装置A的质量增加,B的质量不变,从而实验气,并写出化学反应式;
(3)只有二氧化碳生成的才使装置A的质量不变,B的质量增加,从而确定实验气;然后写出二氧化碳通过B瓶时的化学反应式;
(4)根据装置A、B的质量都增加,确定试验气的种类;根据化学反应式计算出A的质量增加值即可.
解答 解:(1)C2H6燃烧生成二氧化碳和水;H2燃烧生成水;CO燃烧生成二氧化碳.所以要确定C2H6、H2和CO三种可燃性气体,就要能吸收水和二氧化碳的物质,故A中可放浓硫酸,B中可放氢氧化钠溶液或石灰水.
故答案为:浓硫酸;氢氧化钠溶液或石灰水;
(2)装置A的质量不变,B的质量增加,说明只有二氧化碳生成,试验气是一氧化碳;
故答案为:CO;
(3)装置A、B的质量都增加,说明生成的气体中既有水又有二氧化碳,试验气是C2H6;燃烧的方程式为:2C2H6+7O2$\frac{\underline{\;点燃\;}}{\;}$4C02+6H2O;
B的质量增加2.2g,说明有2.2g二氧化碳生成,要求A的质量增加多少,就是求生成了多少水.可根据反应式计算.
设:A的质量增加Xg,即生成Xg水
2C2H6+7O2$\frac{\underline{\;点燃\;}}{\;}$4C02+6H2O
4×44 6×18
mg x
$\frac{4×44}{mg}$=$\frac{6×36}{x}$ x=$\frac{27m}{44}$g
即:A的质量增加$\frac{27m}{44}$g;
故答案是:CH4;2C2H6+7O2$\frac{\underline{\;点燃\;}}{\;}$4C02+6H2O;$\frac{27m}{44}$g.
点评 本题主要考查常见气体燃烧的产物以及根据产物判断物质,同学们一定要了解常见物质的性质.

| A. | 用蒸发结晶的方法除去KNO3中混有的少量NaCl | |
| B. | 用带火星的木条区别空气和O2 | |
| C. | 用水区分NH4NO3和NaOH 两种固体 | |
| D. | 用湿润的石蕊试纸区别CO和CO2 |
| A. | H2中的“2”表示2个氢原子 | |
| B. | H2O中的“2”表示一个水分子中含有2个氢元素 | |
| C. | Mg2+中的“+2”表示镁元素的化合价是+2价 | |
| D. | 2N中的“2”表示2个氮原子 |
| A. | 青蒿素的相对分子质量是282 | |
| B. | 青蒿素中碳元素、氧元素的质量比是9:4 | |
| C. | 青蒿素中氢元素的质量分数最大 | |
| D. | 青蒿素由碳、氢、氧三种元素组成 |

 小明和小红对市场上销售的一种分袋包装的巧克力蛋糕发生了兴趣,因为巧克力蛋糕包装在充满气体的小塑料袋内(如图所示),袋内的气体充得鼓鼓的,看上去好像一个小“枕头”.他们认为这种充气包装技术,主要是为了使食品能够较长时间地保鲜、保质.那么,这是什么气体呢?
小明和小红对市场上销售的一种分袋包装的巧克力蛋糕发生了兴趣,因为巧克力蛋糕包装在充满气体的小塑料袋内(如图所示),袋内的气体充得鼓鼓的,看上去好像一个小“枕头”.他们认为这种充气包装技术,主要是为了使食品能够较长时间地保鲜、保质.那么,这是什么气体呢?

