题目内容
15. 为测定某硝酸银溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定.现取待测液50.0g,滴定过程如图所示.(计算结果均保留1位小数)
为测定某硝酸银溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定.现取待测液50.0g,滴定过程如图所示.(计算结果均保留1位小数)(1)硝酸银溶液的溶质质量为;
(2)计恰好完全反应时,所得溶液的溶质质量分数.
分析 题目给出了生成的氯化银的质量,根据氯化银的质量和对应的化学方程式求算硝酸银的质量和生成的硝酸的质量,进而求算其质量分数.
解答 解:由图可知生成的氯化银的质量为2.87g
设50.0g硝酸银溶液中硝酸银的质量为x,生成的硝酸的质量为y
AgNO3+HCl=AgCl↓+HNO3
170 143.5 63
x 2.87g y
$\frac{170}{x}$=$\frac{143.5}{2.87g}$=$\frac{63}{y}$
x=3.4g
y=1.26g
计恰好完全反应时,所得溶液的溶质质量分数为$\frac{1.26g}{50.0g+10.0g-2.87g}$×100%≈2.2%
答:
(1)硝酸银溶液的溶质质量为3.4g;
(2)计恰好完全反应时,所得溶液的溶质质量分数约为2.2%
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
3.小明将一定量铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.下列对滤渣组成的分析,不可能出现的一组是( )
| A. | Ag | B. | Ag 和 Zn | C. | Cu 和 Ag | D. | Cu、Zn 和 Ag |
20.下列物质的用途错误的是( )
| A. |  聚乙烯塑料做电线外皮 | B. |  酱油中添加铁元素 | ||
| C. |  石灰石做建筑材料 | D. |  木炭吸附一些食品里的色素 |
7.某研究小组对自动充气气球(示意图如图1)进行下列探究.
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
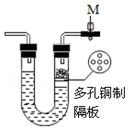
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
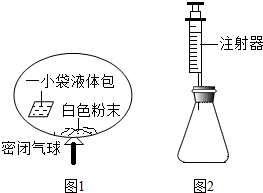
实验①的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;表中x=0.1;V1 >V2(填“>”、“<”或“=”)、
[分析并得出结论]
(5)白色粉末是碳酸氢钠、
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:

| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0、10 | V1 |
| ② | 碳酸钠 | 0、10 | V2 |
| ③ | 白色粉末 | x | V1 |
[分析并得出结论]
(5)白色粉末是碳酸氢钠、
5.在“宏观-微观”之间建立联系,是学习化学学科必备的思维方式.如图是某反应的微观示意图,下列说法正确的是( )


| A. | 该反应中甲、乙、丙、丁都属于化合物 | |
| B. | 反应生成丙、丁分子个数比为1:1 | |
| C. | 参加反应的甲、乙的质量比为60:224 | |
| D. | 该反应不遵守质量守恒定律 |
 如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.
如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.