题目内容
8.日常生活中的下列变化,属于物理变化的是( )| A. |  分离液态空气制氧气 | B. |  用蜡烛制取炭黑 | ||
| C. |  CO2溶于水 | D. |  铁矿石炼铁 |
分析 本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答 解:A、分离液态空气制氧气是利用沸点不同,进行混合物的分离,属于物理变化,故A正确;
B、用蜡烛制取炭黑是蜡烛不完全燃烧的产物,属于化学变化,故B错;
C、二氧化碳溶于水,是二氧化碳与水反应生成碳酸,属于化学变化,故C错;
D、铁矿石炼铁是还原剂与铁的化合物反应生成铁,属于化学变化,故D错.
故选A.
点评 搞清楚物理变化和化学变化的本质区别是解答本类习题的关键.判断的标准是看在变化中有没有生成其他物质.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.

练习册系列答案
相关题目
18. 研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.
研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.
【假设】H2O2生成O2的快慢与催化剂种类有关.
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间.
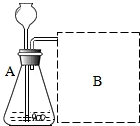
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是锥形瓶,此实验中B处宜采用的气体收集方法是:排水法.
【实验记录】
【结论】该探究过程得出的结论是H2O2生成氧气的快慢与催化剂种类有关.
【反思】H2O2生成O2的快慢还与哪些因素有关?请你帮助他们继续探究.
【假设】H2O2生成氧气的快慢与过氧化氢的浓度有关.
【实验方案】常温下,两瓶相同体积的不同浓度的过氧化氢溶液中分别加入相同质量的MnO2,测量各生成一瓶O2所需的时间.
你若还能提出新的合理的假设和实验方案,本题奖励4分(化学试卷总分布超过60分)
【假设】H2O2生成氧气的快慢与过氧化氢的温度有关.
【实验方案】不同温度下,两瓶相同体积的相同浓度的过氧化氢溶液中分别加入相同质量的MnO2,测量各生成一瓶O2所需的时间.
 研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.
研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.【假设】H2O2生成O2的快慢与催化剂种类有关.
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间.
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是锥形瓶,此实验中B处宜采用的气体收集方法是:排水法.
【实验记录】
| 实验编号 | 1 | 2 |
| 反应物 | 6%H2O2 | 6%H2O2 |
| 催化剂 | 1g红砖粉 | 1gMnO2 |
| 时间 | 152秒 | 35秒 |
【反思】H2O2生成O2的快慢还与哪些因素有关?请你帮助他们继续探究.
【假设】H2O2生成氧气的快慢与过氧化氢的浓度有关.
【实验方案】常温下,两瓶相同体积的不同浓度的过氧化氢溶液中分别加入相同质量的MnO2,测量各生成一瓶O2所需的时间.
你若还能提出新的合理的假设和实验方案,本题奖励4分(化学试卷总分布超过60分)
【假设】H2O2生成氧气的快慢与过氧化氢的温度有关.
【实验方案】不同温度下,两瓶相同体积的相同浓度的过氧化氢溶液中分别加入相同质量的MnO2,测量各生成一瓶O2所需的时间.
19.下列说法正确的是( )
| A. | 含有氧元素的化合物称为氧化物 | |
| B. | 同种元素组成的物质一定是纯净物 | |
| C. | 质子数相同的粒子一定是同种元素 | |
| D. | 多种元素形成的纯净物一定是化合物 |
13.炎热的六月,同学们在帮老师整理实验室时,发现一瓶久置石灰水试剂瓶的瓶壁和瓶塞周围有一些白色粉末,为弄清楚白色粉末的成分及其成因,他们进行了如下探究:
【提出问题】白色粉末成分是什么?
【做出猜想】
猜想一:CaCO3
猜想二:CaCO3和Ca(OH)2
猜想三:Ca(OH)2(因为气温较高,溶质的溶解度降低或溶剂蒸发,使石灰水中的溶质析出)
【设计实验】
(1)甲同学取白色粉末装入试管中,加入少量的水,振荡,发现有白色固体不溶解,于是他认为猜想一正确.乙同学认为甲同学的结论不严密,理由是:Ca(OH)2微溶于水也可能不溶解而沉淀.
(2)为了得出较严密的结论,他们进行了如表实验.
请完成下列实验报告:
【交流反思】
(1)假设猜想二正确,利用上面表格中的步骤进行实验,出现的现象是溶液变红,产生气泡.
(2)通过上述实验探究,同学们向实验室提出保存和使用此类溶液的下列建议中,合理的是AD.
A.密封保存 B.禁止使用这种试剂 C.敞口放置 D.使用前,临时配制
(3)用化学方法除去瓶壁上的白色固体(用化学方程式表示):CaCO3+2HCl═CaCl2+H2O+CO2↑.
【提出问题】白色粉末成分是什么?
【做出猜想】
猜想一:CaCO3
猜想二:CaCO3和Ca(OH)2
猜想三:Ca(OH)2(因为气温较高,溶质的溶解度降低或溶剂蒸发,使石灰水中的溶质析出)
【设计实验】
(1)甲同学取白色粉末装入试管中,加入少量的水,振荡,发现有白色固体不溶解,于是他认为猜想一正确.乙同学认为甲同学的结论不严密,理由是:Ca(OH)2微溶于水也可能不溶解而沉淀.
(2)为了得出较严密的结论,他们进行了如表实验.
请完成下列实验报告:
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取(1)试管中的上层清液,向其中滴加酚酞试液 | 不变色 | 猜想一正确 |
| 取(1)试管中的残留固体,向其中加入稀盐酸 | 有气泡生成 |
(1)假设猜想二正确,利用上面表格中的步骤进行实验,出现的现象是溶液变红,产生气泡.
(2)通过上述实验探究,同学们向实验室提出保存和使用此类溶液的下列建议中,合理的是AD.
A.密封保存 B.禁止使用这种试剂 C.敞口放置 D.使用前,临时配制
(3)用化学方法除去瓶壁上的白色固体(用化学方程式表示):CaCO3+2HCl═CaCl2+H2O+CO2↑.
20.下列事实不能用金属的活动性顺序解释的是( )
| A. | 不能用铜和稀硫酸反应制取氢气 | |
| B. | 相同条件下,锌和铁的与稀硫酸反应的剧烈程度 | |
| C. | 铁能置换出硫酸铜溶液中的铜 | |
| D. | 在化合物中,铁显+2、+3价,铜显+1、+2价 |
18.下列各组物质的名称、俗称、化学式表示同一种物质的是( )
| A. | 氢氧化钠、纯碱、Na2CO3 | B. | 氯化银、食盐、NaCl | ||
| C. | 硫酸铜晶体、胆矾、CuSO4•5H2O | D. | 碳酸钙、生石灰、Ca(OH)2 |
 A、B两图分别表示硫、铁丝在氧气中燃烧示意图
A、B两图分别表示硫、铁丝在氧气中燃烧示意图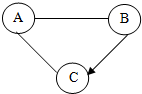 A、B、C为初中化学常见物质,既他们之间有如下图所示关系(“-”表示两种物质间能发生反应,“→”表示两种物质间能够转化,部分反应物或生成物以及反应条件已略去).
A、B、C为初中化学常见物质,既他们之间有如下图所示关系(“-”表示两种物质间能发生反应,“→”表示两种物质间能够转化,部分反应物或生成物以及反应条件已略去).